고려인삼(Panax ginseng, C.A. Meyer)은 오갈피나무과(Araliaceae) 인삼 속 (Panax)에 속하는 다년생 초본류로서, 수천 년 동안 사용되어 온 대표적인 약용식물1)로서, 한의학적 효능은 大補元氣, 健脾益氣, 止渴生津, 安神益智 등으로 요약할 수 있으며2), 항산화 작용3-5), 항노화 작용6), 자양강장 작용7-9), 항암작용10-13) 등의 각종 약리효능이 과학적으로 입증되고 있으며 이에 따라 현대사회에서 다양한 한방의약재료 및 기능성 식품소재로서 개발 수요가 증가하고 있다. 이 중 항암작용은 수많은 연구자들에 의해 진세노사이드의 Rg3와 Rh2가 항암효과14)를 나타내는 것으로 밝혀졌다.
인삼은 대개 수삼, 백삼 그리고 홍삼의 형태로 생산 후 저장, 유통되고 있으며, 수삼은 흙에서 캐낸 그대로의 인삼으로 70-80%의 수분을 함유하고 있어 부패 또는 손상이 발생되기 쉬우며, 백삼은 수삼의 표피를 벗긴 후 자연광에 건조 또는 열풍에 건조하여 제조한 것으로 높은 저장성으로 한약재로 주로 사용되고 이다. 홍삼은 수삼을 장기간 저장할 목적으로 수증기로 2-3시간 정도 찐 다음 말리는 과정, 즉 수삼의 전분이 호환되는 수치 과정을 거치면서 수삼 표피의 색이 붉게 되기 때문에 홍삼이라 불리고 있다. 최근에 보고된 홍삼의 약리효과는 항당뇨 효과15, 16), 항산화효과17), 피부보습효과18), 항암효과13, 19-22), 항고지혈증 효과23) 등으로 알려져 있다.
활성산소종 (reactive oxygen species, ROS)은 호흡과정에서 흡입한 산소 중 일부가 체내 효소계, 환원대사, 물리적 또는 환경적 요인 등에 의해 유독한 물질로 전환되어 세포손상을 일으키는 것으로, 일중항산소(1O2)나 superoxide (O2?), hydroxyl radical (OH?)과 같은 free radical과 과산화수소 (H2O2) 등으로 알려져 있다24). 이들은 분자 구조적으로 매우 불안정하기 때문에 고분자의 세포성분들을 공격하여 산화적 손상들을 유발시킨다. 특히 free radical (NO-, OH-, O2)은 분자상 산소가 활성산소로 변하여 다른 분자들과 반응하면서 생성되어 노화25), 염증26), 발암27), 동맥경화28)와 직접 관련이 있는 것으로 알려져 있다. 최근에 비교적 독성이 적고 안전성 및 관능상의 문제가 되지 않는 천연항산화제 개발을 위하여 연구가 활발히 진행되고 있다.
상기 인삼 및 홍삼의 연구결과는 천연항산화제로서 기능성 식품소재 개발 가능성을 높여 주고 있으며, 본 연구 또한 이러한 과정의 하나로 홍삼의 기능성 식품소재로서의 개발 가능성을 위한 홍삼의 복용 내지는 투여가 항산화활성에 미치는 총 폴리페놀, 총 플라보노이드, ABTS radical 소거능 측정, DPPH radical 소거능 측정하고 정상피부세포주와 암피부세포주의 세포생존율을 관찰하여 유의한 결과를 얻었기에 보고하고자 한다.
본 연구는 우석대학교 본초학교실에서 검증받은 홍삼(강화도 산지, 6년근)을 분말을 만든 후 ethanol에 3일간 냉침하여 용출시킨 추출물을 감압 농축 후 동결건조하여 사용하였으며, naringin, Aluminum Chloride, sodium carbonate, gallic acid, Folin-Ciocalteu's phenol reagent, potassium persulfate, 1,1-diphenyl-2-picrylhydrazyl(DPPH), 2,2‘-azino-bis-3-ethylbenzothiazoline-6-sulphonic acid(ABTS), 2,2-‘Azobis(2-methylpropion-amidine) dihydrochloride, Trolox, pyrogallol, ascorbic acid, sodium nitrite, citrate buffer, acetic acid, naphty-lamine, Tris-base, dimethyl sulfoxide (DMSO) 등은 Sigma(St. Louis, MO, USA)에서 구입하였고, sulfanilic acid는 1급 시약(Kanto chemical, Japan)을 사용하였다.
2.1 총 페놀 함량 측정
총 폴리페놀 함량은 Folin-Denis방법을 변형29, 30하여 따라 Folin-ciacalteu rearent가 자하거의 폴리페놀 화합물에 의해 환원된 결과 몰리브덴 청색으로 발색하는 것을 원리로 분석하였다. 자하거 약침액 시료 100℃에 Folin-Ciocalteau's phenol regent 100℃을 넣고 혼합하여 실온에서 3분간 정치한 뒤 2% Na2CO3 용액 100 ℃을 가하여 혼합 한 후 실온에서 1시간 방치시키고 750 nm에서 흡광도를 측정하였다. 총 페놀함량을 정량분석하기 위해 표준물질인 gallic acid를 증류수에 녹여 일정한 농도별로 조제하고 시료와 동일한 방법으로 실험하여 검량선을 작성하고 시료의 총 페놀 함량을 측정하였다.
2.2 총 플라보노이드 함량 측정
총 플라보노이드 함량은 이의 방법31)을 변형하여 다음과 같이 측정하였다. 0.25 ml 시료에 75 ul NaNO2 (5%, W/V)와 0.15 ml AlCl3(10%, W/V), 0.5 ml 1M NaOH를 혼합하고 2.5 ml 증류수를 첨가한 다음 5 분 동안 37℃에서 반응시킨 후 415 nm에서 spectrometer로 흡광도를 측정하였다. 플라보노이드 함량곡선은 표준 물질인 gallic acid (SIGMN-ALDRICH.Co.,G7384)을 정량하여 작성한 표준 곡선을 작성하고 시료의 총 페놀 함량을 측정하였다.
2.3 ABTS radical 소거능 측정
ABTS radical을 이용한 항산화능의 측정은 potassium persulfate와의 반응에 의해 생성되는 ABTS free radical이 샘플 내의 항산화 물질에 의해 제거되어 radical 특유의 색인 청록색이 탈색되는 것을 이용한 방법으로 Van den Berg 등의 방법을 변형30)하여 측정하였다. 1 mM의 AAPH는 100 mM의 PBS buffer에 녹인 2.5 mM의 ABTS와 혼합한 후 68℃의 항온수조에서 30분간 반응 시켰다. ABTS 용액의 농도는 734 nm에서 흡광도가 0.8±0.1 정도가 되도록 조정하였다. 농도별로 희석한 자하거 약침액의 시료 20℃와 980℃ ABTS 용액을 37℃ water bath에서 15분간 반응시킨 후 734nm에서 감소하는 흡광도의 정도를 측정하였으며 이때 양성대조군은 Trolox 100 ㎍/㎖을 사용하였다.
ABTS radical 소거능은 다음과 같이 측정하였다.
ABTS scavenging ability (%) =시료 처리구 흡광도 / 무처리구 흡광도 × 100
2.4 DPPH radical 소거능 측정
DPPH assay는 Dietz등32)의 실험법을 따랐다. 농도별 자하거 약침액과 0.2 mM DPPH 시약을 30분간 반응시킨 뒤 spectrophotometer를 사용하여 520 nm에서 흡광도를 측정하여 DPPH의 환원에 의한 흡광도 감소를 조사하였다. 무처리구와 처리구의 값을 비교하여 free radical 소거활성을 결정하였다. 이때 기존의 항산화제인 ascorbic acid를 대조구로 사용하였다.
DPPH radical 소거능은 다음과 같이 구하였다.
DPPH scavenging ability (%) =1 - (시료 처리구 흡광도 / 무처리구 흡광도) × 100
2.5 세포배양 및 세포 생존율 측정
실험에 사용한 MCF 10A 세포주는 American Type Culture Collection(ATCC, USA)에서 구매하였으며, SK-MEL-2 사람 피부암 세포주는 국립암센터로부터 분주받아 사용하였다. 배양액은 Lonza 사의 MEGM BulletKit을 하용하였고 각 세포주를 BulletKit에 포함된 BPE (Bovine Pituitary Extract), hEGF (human epidermal growth factor), hydrocortisone, isulin과 추가로 100 ng/ml cholera toxin, penicillin, streptomycin이 첨가된 MEGM medium에서 며칠간 배양하였다. 배양 중이던 세포를 trypsin/EDTA 용액으로 처리한 후, 96 well plate에 well당 각각 1.5×103 cells(MCF 10A 세포주), 7.0×103 cells(SK-MEL-2 사람 피부암 세포주) 씩 분주하고 배양하였다. 24시간이 지난 후에 배양 중이던 medium을 제거한 후, supplements를 제외하고 penicillin과 streptomycin만이 첨가된 MEGM medium에 각각의 추출물을 지정된 농도로 희석하여 각각의 well에 주입하였으며 48시간을 추가로 배양한 후 세포의 생존율을 PrestoBlue (Invitrogen) 시약으로 확인하였다.
모든 실험은 3회 반복 수행하여 평균 ± 표준편차의 형식으로 나타냈었다. 각 실험의 통계처리는 origin 6.0 소프트웨어로
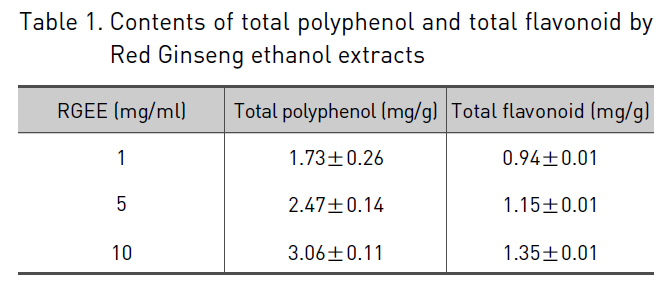
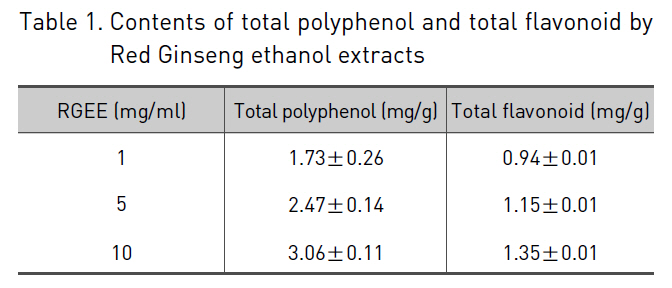
1. 총 폴리페놀 함량과 총 플라보노이드 함량 측정 결과
홍삼 에탄올 추출물의 총 폴리페놀 함량과 총 플라보노이드 함량을 1 mg/ml, 5 mg/ml, 10 mg/ml에서 측정하였다.
홍삼 에탄올 추출물에 함유된 총 폴리페놀 함량은 각각의 농도에서 1.73 ± 0.26 mg/g, 2.47 ± 0.14 mg/g, 3.06 ± 0.11 mg/g으로 관찰되었으며, 총 플라보노이드 함량은 각각의 농도에서 0.94 ± 0.01 mg/g, 1.15 ± 0.01 mg/g, 1.35 ± 0.01 mg/g으로 측정되었으며, 이러한 결과는 박 등17)의 결과와 유사하였다 (Table 1).
[Table 1.] Contents of total polyphenol and total flavonoid by Red Ginseng ethanol extracts
Contents of total polyphenol and total flavonoid by Red Ginseng ethanol extracts
ABTS법은 pH의 변화에 민감하게 반응하지 않는 장점이 있어 간접적인 방법 중에서 가장 많이 사용되는 방법으로 식품과 천연 수용성 페놀성 물질을 측정하기 위래 널리 이용되었다. 페놀성 화합물이 없을 경우 ABTS는 비교적 안정하지만, 페놀성 화합물과 같은 수소공여체(H-donor)와는 강렬하게 반응하여 무색의 ABTS로 변환된다. 따라서 항산화 활성은 페놀성 화합물을 함유한 시료와 반응하여 소비된 ABTS의 양을 600-750 nm의 범위에서 흡광, 정량하여 측정한다.
홍삼 에탄올 추출물의 ABTS radical 소거능은 각각의 농도 3.13, 6.25, 12.50, 25.00, 50.00 mg/ml에서 20.74 ± 1.21, 28.23 ± 1.12, 39.42 ± 0.19, 62.48 ± 0.23, 85.20 ± 0.13%으로 관찰되었으며, 이 결과는 상기 실험 (Table 1)의 결과와 부합하였다 (Fig. 1).
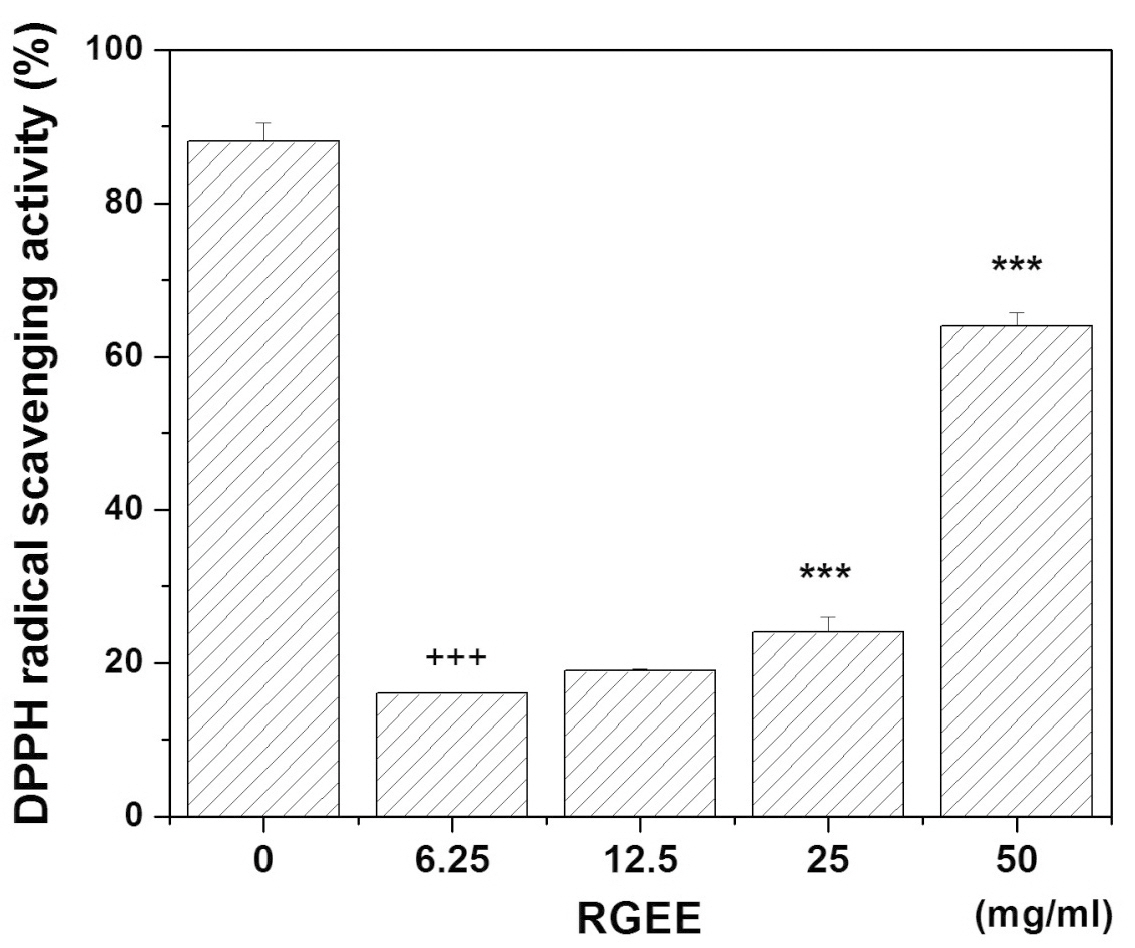
비록 pH, 빛 그리고 온도에 영향을 받으나, 보라 빛을 나타내는 DPPH 라디칼은 비교적 안정한 화합물로 항산화제와의 반응에 의해 라디칼이 소거되어 노란색으로 탈색되는 점을 이용하여 항산화 활성을 검정하는데 사용된다.
홍삼 에탄올 추출물의 6.25, 12.50, 25.00, 50.00 mg/ml 농도에서 각각 약16%, 19%, 24%, 64%로 관찰되었다. 이러한 결과는 상기 실험결과인 (Table 1)의 결과에 부합하였다 (Fig. 2).
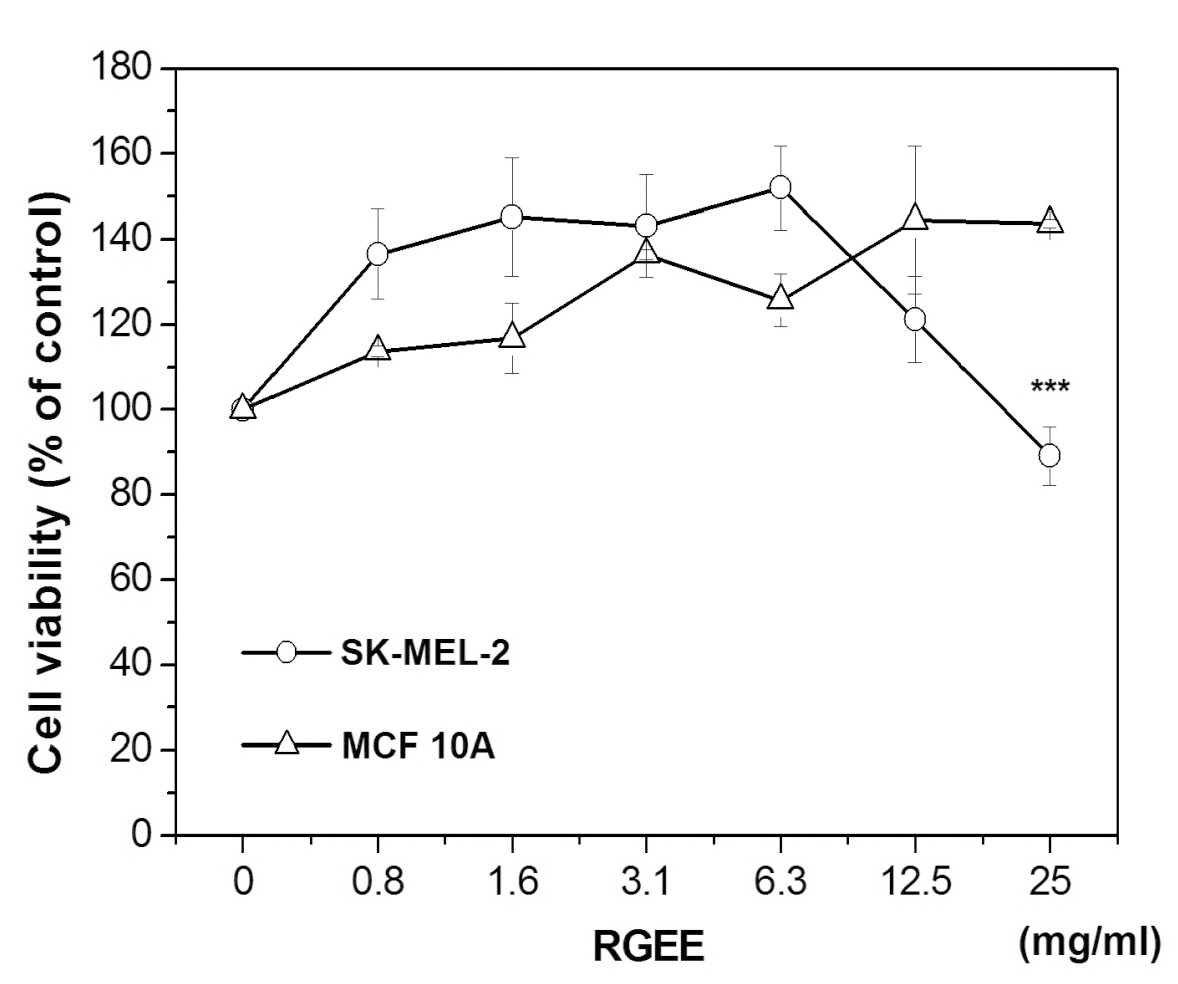
다음은 홍삼 에탄올 추출물이 피부 정상세포(MCF 10A)와 암세포(SK-MEL-2)의 세포생존율에 미치는 영향에 대하여 농도별로 관찰하였다.
홍삼 에탄올 추출물의 농도는 0, 0.8, 1.6, 3.1, 6.3, 12.5, 25.0 mg/ml이였으며, 피부암세포주에서는 저농도에서 세포생존율 증가 현상이 관찰(최고 6.3 mg/ml에서 약 152%로 관찰됨)되었으나, 12.5 mg/ml에서는 약 120%로 세포생존율 감소현상이 관찰되었으며 25 mg/ml에서는 약 89%로 오히려 대조군보다 낮은 수치가 관찰되었으며 이러한 결과는 박의 결과20)와 부합하였다.
또한 피부 정상세포주에서는 이러한 현상이 관찰되지 않고 세포생존율은 계속 증가하여 최종 농도인 25 mg/ml에서 143%까지 증가하여(p<0.001) 이33)와 Fishbein19) 등의 결과와 부합하였다.
이러한 의미는 흥미로운 결과로 홍삼에탄올 추출물이 암세포주에서는 세포생존율을 억제하고 정상세포주에서는 세포생존율을 증가시키는 작용이 있음을 의미한다고 사료된다. 이러한 결과의 원인 가능성으로는 암세포주의 세포증식 신호 기전과 정상세포주의 세포증식 신호 기전이 다를 수 있음을 의미하거나 홍삼의 에탄올 추출물에서 2가지 이상의 작용물질이 있어 선택적으로 작용하고 있을 것이라 사료되었다 (Fig. 3).
홍삼의 기능성 식품소재로서의 개발 가능성을 위한 홍삼의 복용 내지는 투여가 항산화활성에 미치는 총 폴리페놀, 총 플라보노이드, ABTS radical 소거능 측정, DPPH radical 소거능 측정하고 정상피부세포주와 암피부세포주의 세포생존율을 관찰하여 다음과 같은 결과를 얻었다.
홍삼 에탄올 추출물에는 총 폴리페놀과 총 플라보노이드 함량이 농도의존적으로 증가하고 있으며, ABTS radical 소거능과 DPPH radical 소거능 역시 농도의존적으로 증가하였다. 또한 암피부세포주인 SK-MEL-2에서는 세포생존율 감소결과를 피부정상 세포주인 MCF 10A에서는 세포생존율 증가 결과를 나타내었다.
이상의 결과로 홍삼 내지 홍삼 추출물은 생체 내 정상적 세포활동을 활성화시키며 비정상적 세포활동은 억제시키므로 이러한 성질을 이용하여 약침 원액이나 기능성 식품소재로서의 개발 가능성이 매우 높으므로 이에 대한 연구와 개발이 필요하다고 사료된다.