유글레나는 엽록체를 가지고 광합성을 하는 점에서는 식물로 취급하지만, 세포벽이 없고 편모로 유영생활을 하는 점에서는 동물의 편모충류로 분류하기도 한다(Ruiz et al., 2004; Rodríguez-Zavala et al., 2010). 유글레나는 Vitamin E, Pramylon와 같은 기능성 물질 뿐만 아니라 EPA와 DHA 같은 오메가-3 고도불포화지방산을 함유하고 있기 때문에 어류 자치어의 먹이생물도 관심을 받고 있다(Harwood, 1988; Hayashi et al., 1993; James and Browse, 1999; Barsanti et al., 2000; Choi et al., 2013). 이들 기능성물질과 지방산의 함량은 자가영양배양(autotrophic), 타가영양배양(heterotrophic) 및 혼합영양배양(Mixotrophic) 배양조건에 따라서 달라진다(Wen and Chen, 2003; Wang et al., 2012). 즉 목적하는 기능성물질을 얻기 위해서는 배양방법의 결정이 중요하다. 전보(Jeong et al., 2015)의 연구에 의하면 유글레나의 바이오매스와 오메가-3고도불포화지방산의 함량 측면에서는 혼합배양방법이 최적배양방법인 것으로 나타났다. 따라서 본 실험에서는 혼합영양배양 조건하에서 배양온도와 pH와 같은 물리적 환경조건과 탄소원, 질소원 및 C/N비율과 같은 영양조건을 달리했을 때 따른 유글레나의 성장과 지질에 미치는 최적 배양조건을 구하고자 하였다.
본 실험에 사용된 균주 Euglena gracilis KMMCC-1351는 한국해양미세조류은행(KMMCC) 으로부터 분양 받아 사용하였으며, 배양에 사용한 배지는 Table 1에 나타낸 바와 같이 Hutner medium (Leticia et al., 1997)을 사용하였다. 제조한 배지는 121℃에서 15분간 고압 멸균하여, 초기 접종은 0.62 g/L로 7일간 3반복으로 배양하였으며, 바이오매스의 측정은 고속원심분리기(UNION 32R, Hanil Science Industrial Co., Ltd. Korea)에서 3,000 rpm으로 25분간 원심 분리한 후, 배양액은 버리고 세포만 측정하였다.
배양온도에 따른 실험은 진탕배양기(KSI-200L, Koencon Co., Ltd)를 이용하여 15℃, 20℃, 25℃, 30℃ 그리고 35℃로 실시하였으며, pH에 따른 실험은 0.1 N HCl과 0.1 N NaOH를 이용하여 pH 3.5, pH 4.5, pH 5.5, pH 6.5, pH 7.5 그리고 pH 8.5로 실험을 실시하였다. 배양이 완료된 배양액은 4℃의 고속 원심분리기(UNION 32R, Hanil Science Industrial Co., Ltd. Korea)에서 3,000 rpm으로 25분간 원심 분리한 후, 배양액은 버리고 세포만 회수하여 동결 건조하여 분석에 사용하였다.
영양조건에 따른 실험은 탄소원의 종류, 질소원의 종류 그리고 C/N 비율에 따른 실험을 실시하였다. 탄소원에 따른 성장은 Hutner medium 을 기본배지에 탄소원인 Glucose 를 제외하여 Fructose, Lactose, Glucose, Maltose 그리고 Sucrose를 각각 1.5% (w/v)로 공급하여 배양하였다. 질소원에 따른 성장은 Hutner medium 을 기본배지에 질소원인 sodium glutamate을 제외하여 Tryptone, Peptone, Yeast extract, Urea 그리고 sodium glutamate 사용하여 각각 0.5% (w/v) 공급하여 배양하였다. C/N 비율에 따른 성장은 탄소원으로 glucose와 질소원으로 sodium glutamate 를 이용하여 질소원인 sodium glutamate 1.0 g/L으로 고정시키고, 탄소원인 glucose 농도를 각각 1.0 g/L, 5.0 g/L, 10 g/L, 20 g/L 그리고 30 g/L 공급하여 C/N 비율이 각각 1, 5, 10, 20 그리고 30 비율로 조정하여 배양하였다. 이때의 배양온도는 25±0.5℃, 광주기는 18L:6D, 주간의 조도는 3,000 lx로 유지하였다.
총 지질 추출은 Bligh and Dyer방법(1959)에 준하였다. 비커에 균체 5 g을 취하여 세포분쇄기(homogenizer AM-12, Nihonseiki Kaisha Co. Ltd., Tokyo, Japan)에서 15,000 rpm로 5분간 분쇄한 후, Chloroform과 Methanol을 2:1로 혼합한 추출 용매를 시료의 2배량 넣어 하루 동안 방치한 다음 chloroform 층만을 분리하기 위하여 둥근 플라스크 위에 깔때기를 놓고, 그 위에 Na2SO4를 넣어 서서히 chloroform층만 흘러내리게 하였다. 분리된 chloroform 층은 진공회전농축기(Rotavapor R-114, BUCHI)를 사용하여 40℃이하에서 용매를 완전히 증발시킨 후, 추출된 총 지질의 무게를 측정하였다. 모든 작업은 질소 기류 하에서 행하였다. 지방산 methyl ester 유도체化는 시료 일정량과 내부표준물질(C23:0 methyl ester) 1 mL (1 mg)를 cap tube에 취하고, 0.5 N NaOH-methanol 용액 1.5 mL를 가하여 질소를 충진한 다음, 100℃에서 8분간 가열하여 검화하였다. 방냉 후 12% BF3-methanol 2 mL를 가한 후 tube의 뚜껑을 닫고, 100℃에서 11분간 가열하여 methyl화 하였다. 약 30℃로 냉각한 후 Iso-octane 1mL를 첨가하고 30초간 vortex mixer로 혼합하였다. 즉시 3 mL의 포화식염수를 가한 다음 흔들어 방치하여 iso-octane층이 분리되도록 하였다. iso-octane층을 시료병(4 mL)에 옮긴 후, 다시 iso-octane 1 mL를 첨가한 다음 흔들어 재추출하여 시료 병에 모으고 이를 지방산 methyl ester 시료로 하였다. 지방산 분석에 사용하는 GLC는 OmegawaxTM-320 fused-silica capillary column (30 m×0.32 mm×0.25 μm, i.d., Supelco Co., Bellefonte, PA, USA)를 장착한 Clarus 600 (Perkin Elmer Co. Ltd., USA)를 이용하였다. 분석조건으로 Column은 185℃에서 8분간 유지하고 3℃/min씩 230℃까지 상승시킨 후, 10분간 유지하였다. 이 때 주입기는 250℃, 검출기는 270℃ 그리고 carrier gas는 He (1.0 kg/cm2)을 사용하였다. 지방산의 분석은 동일조건에서 분석한 표준품의 ECL과 비교하여 동정하였고, 지방산 표준품은 14:0, 16:0, 18:1, 18:2, 18:3, 20:0, 22:1, 24:0 (Sigma Chemical Co., St. Louis, MO, USA)과 GC-MS로 동정된 menhaden oil을 사용하였다.
모든 자료는 SPSS (16.0) 프로그램을 이용하여 분산분석 (one-way ANOVA)과 회귀분석(Regression Analysis)을 실시하여 Duncan's multiple range test (Duncan, 1955)로 평균간의 유의성(P<0.05)을 검정하였다.
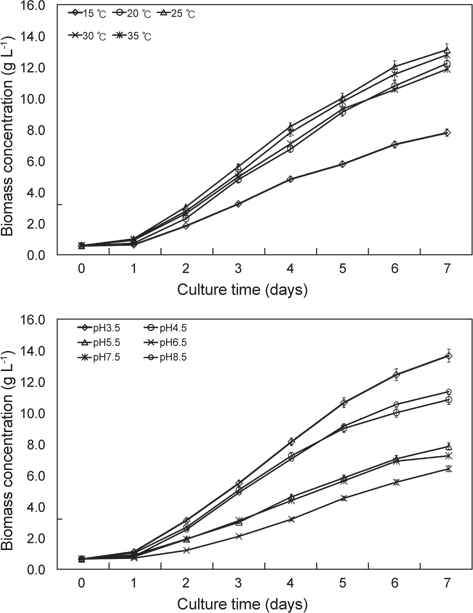
배양온도와 pH에 따른 E. gracilis 의 성장은 Fig. 1에 나타낸 바와 같다. 배양온도15℃, 20℃, 25℃, 30℃ 그리고 35℃ 에서 실험구마다 0.62 g/L로 접종하여 1일 경과 후 각각 0.68 g/L, 0.78 g/L, 1.06 g/L, 1.03 g/L 그리고 0.98 g/L였으며, 2일 경과 후에는 1.88 g/L, 2.36 g/L, 3.10 g/L, 2.83 g/L 그리고 2.68 g/L였다. 3일 경과 후 15℃, 20℃, 25℃, 30℃ 그리고35℃ 구에서 각각 3.28 g/L, 4.83 g/L, 5.67 g/L, 5.22 g/L 그리고 5.01 g/L였으며, 4일 경과 후에는 각각 4.86 g/L, 6.78 g/L, 8.22 g/L, 7.83 g/L 그리고 7.12 g/L로 성장하였다. 5일 경과 후 15℃, 20℃, 25℃, 30℃ 그리고35℃ 구에서 각각 5.82 g/L, 9.16 g/L, 10.05 g/L, 9.82 g/L 그리고 9.35 g/L였으며, 6일 경과 후에는 각각 7.08 g/L, 10.82 g/L, 12.06 g/L, 11.56 g/L 그리고 10.60 g/L로 성장하였다. 7일 경과 후15℃, 20℃, 25℃, 30℃ 그리고35℃구에서 각각 7.83 g/L, 12.25 g/L, 13.12 g/L, 12.80 g/L 그리고 11.88 g/L로 성장하여 배양온도에 따른 성장은 25℃에서 가장 높은 성장은 나타내었지만 30℃구와 유의적인 차이는 보이지 않았다(P<0.05). 다음으로 20℃와 35℃ 순으로 나타났으며(P<0.05), 15℃구에서 가장 낮은 성장을 보였다(P<0.05). 이로서 E. gracilis의 성장에 가장 적합한 배양온도는 25-30℃로 나타냈다. pH에 따른 pH 3.5, pH 4.5, pH 5.5, pH 6.5, pH 7.5그리고 pH 8.5에서 실험구마다 동일하게 0.62 g/L로 접종하여 1일 경과 후 각각 1.08 g/L, 1.00g/L, 0.88 g/L, 0.68 g/L, 0.78 g/L 그리고 0.80 g/L였으며, 2일 경과 후에는 3.08 g/L, 2.66g/L, 1.90 g/L, 1.18 g/L, 1.88 g/L 그리고 2.50 g/L로 성장하였다. 3일 경과 후 pH 3.5, pH 4.5, pH 5.5, pH 6.5, pH 7.5그리고 pH 8.5에서 각각 5.46 g/L, 5.03g/L, 2.98 g/L, 2.08 g/L, 3.08 g/L 그리고 4.86 g/L였으며, 4일 경과 후에는 각각 8.10 g/L, 7.22g/L, 4.60 g/L, 3.16 g/L, 4.36 g/L 그리고 7.02 g/L로 성장하였다. 5일 경과 후 pH 3.5, pH 4.5, pH 5.5, pH 6.5, pH 7.5그리고 pH 8.5에서 각각 10.6 g/L, 8.96 g/L, 5.81 g/L, 4.50 g/L, 5.62 g/L 그리고 9.11 g/L였으며, 6일 경과 후에는 각각12.38 g/L, 9.96 g/L, 7.02 g/L, 5.52 g/L, 6.88 g/L 그리고 10.50 g/L로 성장하였다. 7일 경과 후 pH 3.5, pH 4.5, pH 5.5, pH 6.5, pH 7.5그리고 pH 8.5에서 각각 13.60 g/L, 10.80 g/L, 7.82 g/L, 6.38 g/L, 7.22 g/L 그리고 11.30 g/L로 성장하여 pH에 따른 성장은 pH 3.5에서 가장 높은 성장은 나타내었으며(P<0.05), 다음으로 pH 8.5와 pH 4.5로 나타났다(P<0.05). 대부분의 미생물들은 pH 6.5-7.5의 중성적인 환경에서 잘 생육하는 것과는 다르게 pH 3.5와 pH 8.5같은 극한의 환경에서 성장이 우수한 것으로 나타났다.
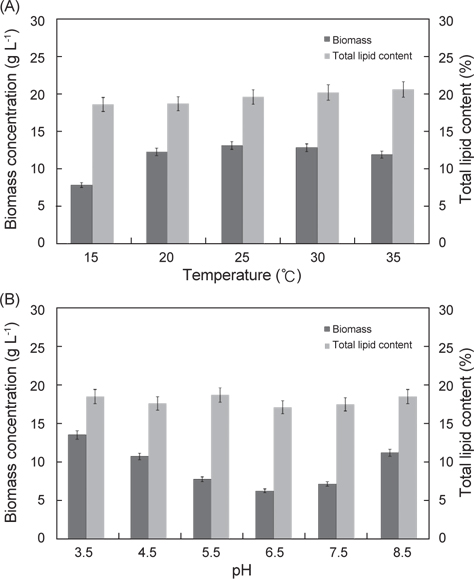
배양온도와 pH에 따른 E. gracilis의 지질함량은 Fig. 2에 나타낸 바와 같다. 배양온도 15℃, 20℃, 25℃, 30℃ 그리고 35℃에서 각각 18.8%, 18.7%, 19.6%, 20.2% 그리고 20.6%로 배양온도에 따른 지질함량의 실험구들 간의 차이는 보이지 않았으며(P<0.05), pH에 따른 pH 3.5, pH 4.5, pH 5.5, pH 6.5, pH 7.5그리고 pH 8.5에서 지질함량은 각각 18.6%, 17.7%, 18.8%, 17.2%, 17.6% 그리고 18.6%로 pH에 따른 지질함량의 실험구들 간의 차이는 없는 것으로 나타났다(P<0.05).
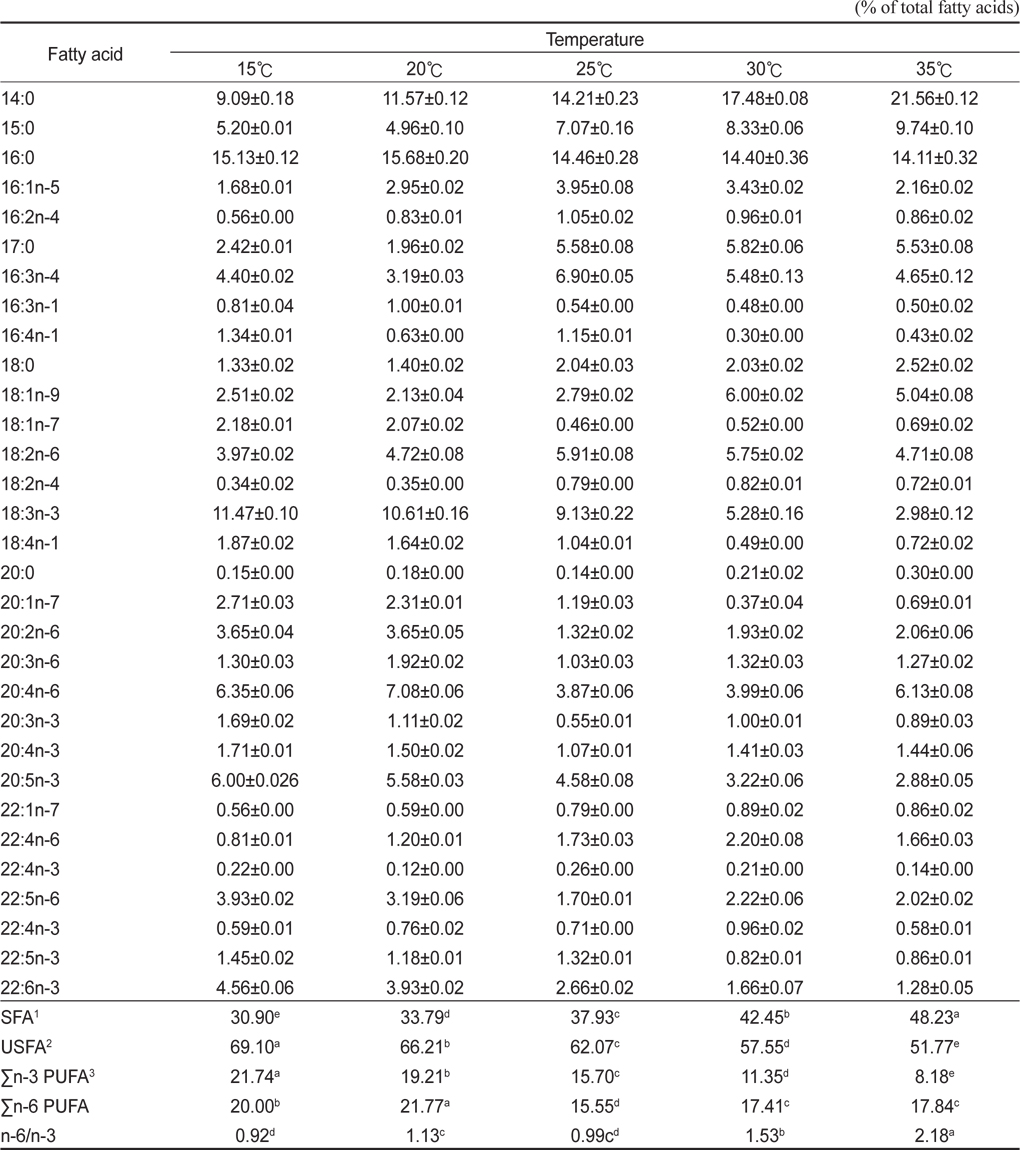
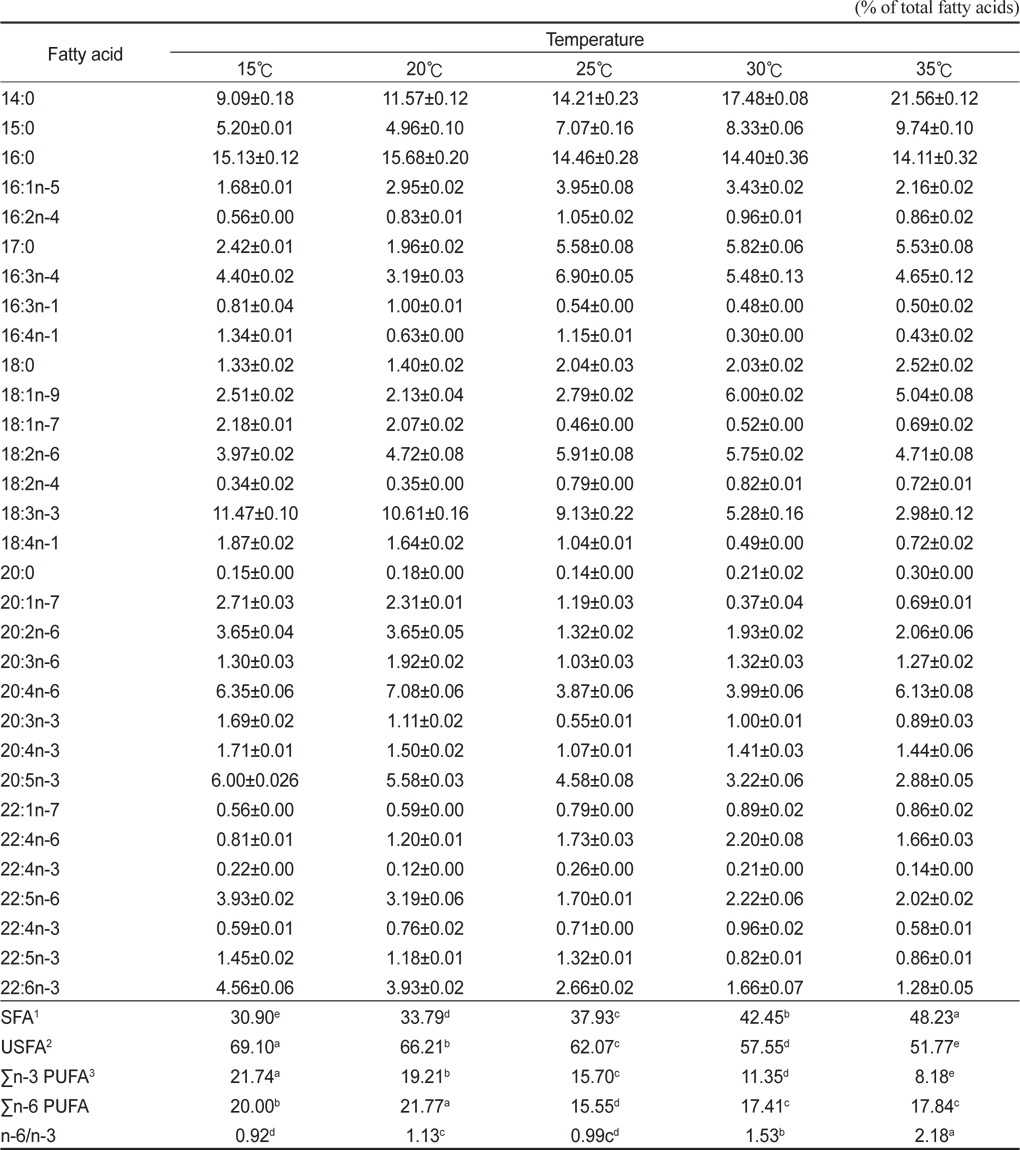
배양온도에 따른 E. gracilis 의 지방산 조성은 Table 2에 나타낸 바와 같다. 포화지방산의 경우 15℃, 20℃, 25℃, 30℃ 그리고 35℃에서 각각 30.90%, 33.79%, 37.93%, 42.45% 그리고 48.23%로 배양 온도가 상승할수록 증가하는 것으로 나타났으며(P<0.05), 불포화지방산의 경우는 각각 69.10%, 66.21%, 62.07%, 57.55% 그리고 51.77%로 배양온도가 상승할수록 감소하는 것으로 나타났다(P<0.05). 또한 18:3n-3의 경우 15℃, 20℃, 25℃, 30℃ 그리고 35℃에서 각각 11.47%, 10.61%, 9.13%, 5.28% 그리고 2.98%로 나타났으며, 20:5n-3(EPA)의 경우 각각 6.00%, 5.58%, 4.58%, 3.22% 그리고 2.88%였으며, 22:6n-3(DHA)의 경우는 각각 4.56%, 3.93%, 2.66%, 1.66% 그리고 1.28%로 나타났다. 이러한 18:3n-3, 20:5n-3 22:6n-3 모두 배양온도가 높아짐에 따라 낮아지는 경향을 보였다. Σn-3 HUFA (Highly unsaturated fatty acid)의 경우 15℃, 20℃, 25℃, 30℃ 그리고 35℃에서 각각 21.74%, 19.21%, 15.70%, 11.35% 그리고 8.18%로 나타났으며, Σn-6 HUFA의 경우 각각 20.00%, 21.77%, 15.55%, 17.41% 그리고 17.84%으로 나타났다. 배양온도는 미세조류에 의해 생산된 지방산의 종류에 중요한 영향을 미치며(Ackman et al., 1968; Satu and Murata, 1980; Thompson et al., 1992), 일반적으로 많은 미세조류 종들은 성장온도가 감소하였을 때 불포화지방산의 비율이 증가하는 것으로 알려져 있다(Mortensen et al., 1988; James et al., 1989; Renaud et al., 1999; Oliveira et al., 1999; Jiang and Chen, 2000). 이번 실험을 통해서 배양온도에 따라 유글레나의 지방산조성에도 현저한 차이를 보이는 것으로 나타났다. 특히, 배양온도가 높을수록 포화지방산의 비율은 높아진다는 여러 문헌의 결과들과 일치하는 결과를 나타내었다. 또한, 특징적인 것은 배양온도가 높아질수록 전형적인 Σn-3계열이 낮아지는 것으로 나타나 지질영양학적 측면에서 낮은 온도에 배양하는 것이 우수한 것으로 나타나 이는 배양조건에 따른 생산 바이오매스량(biomass)과 영양학적인 측면에서 적정배양온도를 찾는 것이 좋을 곳으로 사료된다. 배양온도에 따른 지방산은 인지질과 sterol 지방산의 함량과 조성은 영향을 받는데 식물 조직세포에서 고도불포화지방산은 12℃에서 80%가 형성되나 20℃와 30℃에서는 각각 51%와 30%의 불포화지방산이 합성되며(Browse and Slack, 1993). 온도가 낮으면 불포화 지방산의 양이 많아지는 반면 배양 온도가 높으면 포화지방산의 양이 많아진다고 보고되고 있다(Neidelman, 1987). 이번 연구에서도 온도가 높아짐에 따라 포화지방산의 비율이 높아지는 것과 일치하는 것으로 나타났다.
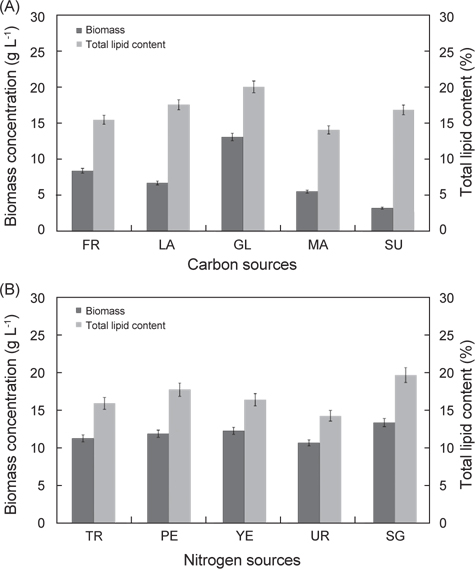
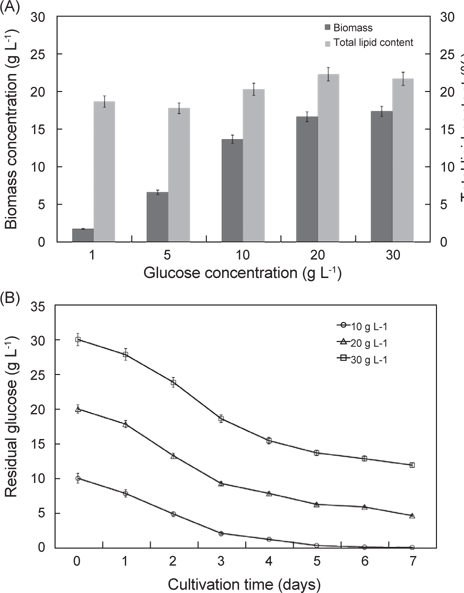
탄소원과 질소원 종류에 따른 실험 결과는 Fig. 3에 나타낸 바와 같다. 탄소원으로 Fructose, Lactose, Glucose, Maltose 그리고 Sucrose를 사용하여 배양한 결과는 각각 8.52 g/L, 6.81 g/L, 13.23 g/L, 5.62 g/L 그리고 3.32 g/L로 glucose를 탄소원으로 사용하는 구에서 가장 높은 성장을 보였으며(P<0.05), 다음으로 fructose, lactose순으로 높게 나타났다. 총지질 함량은 fructose, lactose, glucose, maltose 그리고 sucrose를 사용하여 배양한 결과는 각각 15.6%, 17.7%, 20.2%, 14.2% 그리고 17.0%로 glucose에서 가장 함량이 높았으며(P<0.05), 다음으로 lactose, sucrose 순으로 나타났다(P<0.05). 질소원으로 Tryptone, Peptone, Yeast extract, Urea 그리고 sodium glutamate 를 사용하여 배양한 결과는 각각 11.2 g/L, 11.8 g/L, 12.2 g/L, 10.60 g/L 그리고 13.32 g/L로 sodium glutamate 구에서 가장 높은 성장을 보였으며(P<0.05), 다음으로 yeast extract, peptone 순으로 나타났다. 총 지질 함량은 tryptone, peptone, yeast extract, urea 그리고 sodium glutamate 를 사용하여 배양한 결과는 각각 15.8%, 17.7%, 16.3%, 14.2% 그리고 19.6%로 sodium glutamate에서 가장 함량이 높았으며(P<0.05), 다음으로 peptone, yeast extract 순으로 나타났다(P<0.05). 탄소원과 질소원의 농도에 따른 성장 결과는 Fig. 4에 나타낸 바와 같다. 탄소원으로 glucose와 질소원으로 sodium glutamate 를 이용하여 C/N 비율이 각각 1, 5, 10, 20 그리고 30 비율로 조정하여 배양한 결과는 Fig. 4에 나타낸바와 같이 바이오매스는 각각 1.83 g/L, 6.65 g/L, 13.6 g/L, 16.6 g/L 그리고 17.3 g/L로 C/N 비율이 높아짐에 따라 바이오매스량 또한 높아지는 것으로 나타났으나 C/N 비율이 10이상에서 바이오매스량은 성장이 둔화되는 것으로 나타났다. 총 지질 함량은 C/N 비율이 각각 1, 5, 10, 20 그리고 30 비율일 때 각각 18.6%, 17.8%, 20.2%, 22.3% 그리고 21.6%로 C/N 비율이 10, 20, 30 구에서 유의적 차이가 없이 높은 것으로 나타났다(P<0.05). 또한 C/N 비율에 따라 탄소원의 소모량을 측정한 결과 C/N 비율이 10 일 때 배양 1, 2, 3, 4, 5, 6 그리고 7일 경과 후 각각 7.82 g L-1, 4.86 g L-1, 2.08 g L-1, 1.23 g L-1, 0.36 g L-1, 0.12 g L-1 그리고 0.08 g L-1였으며, C/N 비율이 20 일 때 각각 17.81 g L-1, 13.22 g L-1, 9.26 g L-1, 7.84 g L-1, 6.25g L-1, 5.88 g L-1 그리고 4.63g L-1로 나타났다. C/N 비율이 30 일 때 배양 1, 2, 3, 4, 5, 6 그리고 7일 경과 후 각각 27.83 g L-1, 23.81 g L-1, 18.62 g L-1, 15.42 g L-1, 13.65 g L-1, 12.84 g L-1 그리고 11.92 g L-1로 나타났다. C/N 비율이 10일 때 배양시작 후 5일 경과 시점에서 0.36 g L-1로 탄소원의 소모가 거의 완료되는 것으로 나타났지만, C/N 비율이 20과 30 구에서는 7 일간 배양하여도 탄소원의 잔류량이 각각 4.63g L-1 와 11.92 g L-1로 탄소원 모두 소모되지 못하고 잔류되는 것으로 나타났다. 이러한 결과는 C/N 비율이 10일 때 배양 후 5 일 경과 시점에서 모두 소모되는 것으로 보아 추가로 배지를 공급할 경우 5일이 경과 되지 않는 시점에 추가 공급을 해주는 것이 적당하고 하겠다. 이상의 결과로 C/N 비율이 높아짐에 따라 생산되는 바이오 매스는 증가하는 것으로 나타났지만, C/N 비율이 10 이상에서 성장이 현저히 둔화되는 것으로 나타났으며, 배양시간에 따른 탄소원의 소모량을 측정한 결과 C/N 비율은 10일 때 가장 적합한 것으로 사료된다.
미세조류의 생육과 지방산 생성은 배지 조성과 환경조건에 의해서 영향을 받는다. 유지미생물의 지질축척은 배지의 영양소, 대개는 질소가 고갈되었을 때 시작되며(Honda et al., 1998), glucose 농도가 낮으면 지질의 축척이 촉진하였는데 이것은 성장률이 낮았기 때문이라고 보고되고 있다(Jiang and chen, 1992). 또한 지질 농도는 대수증식기에는 감소되었지만, 미지의 배지성분이 제한되어 생육이 지연되면 증가되었다고 한다(Honda et al., 1998). 질소원의 종류에 따라 지질생산에 영향을 미치는 것으로 알려져 있으며(Regnault et al., 1995), M. ramanniana는 potassium nitrate가 포함된 배지를 사용할 경우 ammonium salts가 포함된 배지를 사용하는 경우보다 생성되는 지질의 농도가 높다고 보고되어 있다(Sajbidor et al., 1990). 또한 유지미생물의 지질축척은 배지의 영양소 중에서 질소 성분이 부족할 경우에 축적이 된다고 알려져 있다(Honda et al., 1998). 또한 배지의 질소량은 녹조류, 세균, 곰팡이의 포화지방산과 불포화지방산의 비율에 영향을 준다고 알려져 있으며 (Yokochi et al., 1998), 해양미세조류인 Dunaliella bardawii와 D. salina 등은 질소원이 고갈된 상태에서 지질함량이 높아진다고 보고되어 있지만(Renaud et al., 1995), 담수미세조류인 Scenedesmus 와 Chlorella 에서는 질소원의 농도가 높을 때 지질함량이 증가하는 것으로 보고되고 있다(Piorreck et al., 1984). 또한 곰팡이와 같은 타가영양(heterotrophic) 미생물은 질소원뿐만 아니라 탄소원의 농도도 지질생성을 조절하는 것으로 보고되어 있으며(Watanabe et al., 1997; Kim et al., 2005a, 2005b), Motierella ramanniana 균체인 경우 C/N비율이 높으면 총 지질함량이 증가할 뿐만 아니라 고도불포화지방산의 수율도 증가되는 것으로 보고되어 있다(Sajbidor et al., 1990). 지질의 농도는 대수증식기에는 감소되었지만, 미지의 배지성분이 제한되어 생육이 지연되면 지질의 생산은 계속 증가되었다고 한다(Honda et al., 1998). 따라서 지질 생산도 생육과 같이 생육제한 조건 즉, 세포의 성장이 이루어지고 정체기 시기에 영양성분이 제한되어 스트레스를 받게 되면 지질함량이 증가되었으며(Navarro et al., 1997), 탄소원을 기질로 이용하여 지질을 생산한다는 사실은 오래 전부터 알려져 왔다(Perez-Garcia et al., 2011). 균종에 따른 지질 생산량과 그 지방질의 조성 등이 많은 연구자에 의하여 밝혀지고 있으며(Fan et al., 2002; Wu et al., 2005; Zhu et al., 2007), 이상의 결과에서 배양방법과 영양 성분에 따른 유글레나의 성장은 생리적인 부분에서 많은 차이를 보이는 것으로 보아 배양환경과 영양조건에 따른 변화가 나타내고 있다. 이러한 점을 고려할 때 본 연구는 배양조건에 따른 지방산의 변동에 관한 연구가 거의 미미한 상태에서 그 기여도가 클 것으로 생각한다.