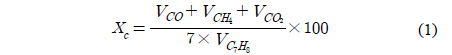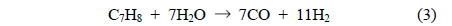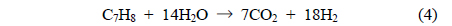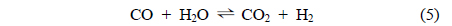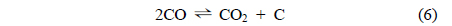Steam reforming of tar produced from biomass gasification was conducted using several Ni-based catalysts. In labscale, the catalytic steam reforming of toluene which is a major component of biomass tar was studied. A fixed bed reactor was used at various temperatures of 400-800 ℃. Ru (0.6 wt%) and Mn or K (1 wt%) were applied as a promoter in Ni based catalysts. Generally, Ni/Ru-K/Al2O3 catalyst shows higher performance on steam reforming of toluene than Ni/Ru-Mn/Al2O3 catalyst. Used catalysts were analyzed by XRD and TGA to detect sintering and carbon deposition. Base on the lab-scale studies, the monolith and pellet type catalysts were tested in 1 ton/day scale biomass gasification system. Ni/Ru-K/Al2O3 monolith catalyst shows high tar reforming performance at high temperature. In addition, Ni/Ru-Mn/Al2O3 monolith catalyst was showed deactivation with operation time. Reforming performance of Ni/Ru-K/Al2O3 pellet catalyst which showed 66.7% tar conversion at 587 ℃ was compared to regenerated one. Overall, Ni/Ru-K/Al2O3 pellet catalyst shows higher stability and performance than other used catalysts.
바이오매스는 인류가 오래전부터 사용한 에너지원이었으며 화석연료에 비해 지역 편중적이지 않은 장점이 있다. 또한 생장 기간 동안 CO2를 소비하므로 온실가스를 배출하지 않는 신재생에너지원으로 주목받고 있다[1, 2]. 이러한 바이오매스의 에너지화를 위한 직접연소, 열분해, 가스화 등의 방법이 연구되고 있다. 이 중 가스화는 열에너지와 함께 활용성이 높은 합성가스를 생산할 수 있는 유용한 방법이다[3-5]. 가스화를 통해 생산된 합성가스는 주로 H2, CO로 구성되어 있으며 전력생산이나 화학물질 합성 등 다양한 분야에 적용할 수 있다[6-9].
목질계 바이오매스는 보통 셀룰로오스(50 wt.%), 헤미-셀룰로오스(20 wt.%), 리그닌(30 wt.%)으로 구성되어 있다[3]. 이 중 열적으로 안정한 리그닌은 바이오매스 가스화 과정에서 타르로 전환되어 합성가스와 함께 배출된다[3]. 타르는 탄화수소로 이루어진 물질로 주로 벤젠과 톨루엔으로 대표되며 다양한 방향족 화합물을 포함하고 있다[10, 11]. 합성가스 내 타르는 바이오매스 가스화 공정에서 파이프나 엔진 등에 부착되어 심각한 문제를 발생시키므로 가스화 공정 내에서 반드시 제거되어야 한다[11, 12]. 이러한 타르의 제거를 위해 산화, 수증기개질 등이 연구되어 왔으며 촉매를 이용한 수증기 개질은 타르 제거와 동시에 추가적인 H2와 CO를 얻을 수 있어 주목받고 있다[13].
타르 수증기개질 촉매로 Pd, Pt와 같은 귀금속, 감람석(olivine), 백운석(dolomite)과 같은 광물, 상대적으로 낮은 비용과 높은 활성을 보이는 Ni계 촉매가 주로 연구되고 있다[14-16]. 그러나 Ni 촉매는 쉽게 탄소침적이 발생하여 반응기의 흐름이 막히게 되고, Tammann temperature 이상에서는 Ni 결정들이 소결되어 활성이 저하된다[17, 18]. 따라서 Ni 촉매의 안정성 향상을 위한 촉진제와 촉매의 구조 개선이 연구되어 왔다[19, 20].
알칼리 금속, 알칼리 토금속, 란탄족 등이 탄소침적과 Ni의 분산도에 영향을 주는 것으로 보고되었고 촉매 구조 내 산소의 이동, 저장 등 촉진제 각각의 역할에 대해서 연구되고 있다[6, 21-24]. 또한 촉매의 기공(pore) 크기, Ni 결정크기 등이 촉매 활성에 미치는 영향이 연구되며 반응식 연구를 통한 활성화 에너지, 속도 결정 단계 등이 보고되고 있다[25, 26].
바이오매스 가스화 시스템에 주로 적용되는 촉매의 형태는 펠렛과 모노리스가 있다. 펠렛 촉매는 제작이 쉽고 모노리스에 비해 단위 부피당 많은 양의 촉매가 사용될 수 있으나, 압력 손실, 채널링 등에 영향을 받아 성능이 저하될 수 있다[27]. 이와 달리 모노리스 촉매는 대부분 벌집 구조의 허니콤 형태로, 반응기내 유체의 흐름이 방해 받지 않아 압력 손실이나 채널링 등의 문제가 적다[27]. 촉매를 이용한 바이오매스 가스화에서 생성되는 합성가스 내 타르의 개질은 주로 실험실적 연구로 진행되었다. 실험실적 연구에서 개발된 촉매를 실제 상용 시스템에 적용하기 위해서는 규모 확대를 통한 비교 연구가 필수적이다.
본 연구에서는 Ru, Mn, K를 탄소침적 저항성과 활성을 향상시키는 촉진제로 Ni 촉매에 첨가하여 타르 개질 효과를 비교하였다. 우선 실험실 규모의 장치에서 모사 타르인 톨루엔의 수증기개질을 수행하여, Mn과 K 첨가로 인한 효과를 직접 비교하고 열중량분석과 X-선 회절분석을 통해 촉매의 특성 변화를 분석하였다. 이러한 결과를 바탕으로 1 톤/일 규모의 고정층 바이오매스 가스화 시스템에 적용 가능한 모노리스와 펠렛 형태로 촉매를 제작하였다. 바이오매스 가스화 시스템을 운전하여 타르가 포함된 합성가스를 생산하고, 이를 제작된 촉매로 타르 수증기개질을 수행하여 실험실 규모의 결과와 비교 및 scale-up에서 발생되는 문제점을 확인하였다.
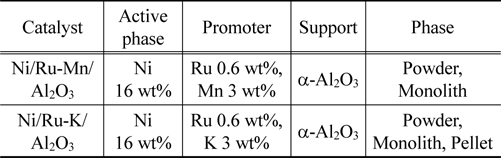
바이오매스 타르 개질 촉매 제작을 위해, nickel nitrate hexahydrate (Ni(NO3)2 6H2O, JUNSEI), Ruthenium chloride hydrate (RuCl2 xH2O, Aldrich), Potassium nitrate (KNO3, Alfa Aesar), Manganess nitrate hydrate (Mn(NO3)2 xH2O, Aldrich)를 α- alumina (Al2O3, Alfa Aesar)에 함침법을 이용하여 조성 별로 담지 하였다(Table 1). 105 ℃에서 24시간 건조한 후, 2 ℃/min의 승온 속도로 800 ℃에서 3시간 동안 소성하였다.
[Table 1.] Chemical composition of catalysts
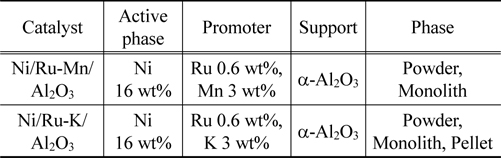
Chemical composition of catalysts
벤치 규모(bench-scale)의 가스화 시스템에 사용되는 타르 개질용 촉매는 위의 방법으로 완성된 촉매를 모노리스와 펠렛 형태로 제작하였다. Ni/Ru-Mn/Al2O3와 Ni/Ru-K/Al2O3 모노리스 촉매에는 코디어라이트(cordierite)를 지지체로 사용하였으며 가로, 세로 150 mm, 높이 300 mm의 직육면체 형태로 셀 밀도는 20 cell/inch2이다. 제작된 가루형태의 Ni/Ru-K/Al2O3와 Ni/Ru-Mn/Al2O3 촉매를 물과 혼합 및 볼밀로 분쇄하여 슬러리로 제조 후, 워시코팅하여 480 g의 촉매를 코팅하였다. 이 후 105 ℃ 오븐에서 30분간 건조하였고 2 ℃/min의 승온 속도로 650 ℃에서 2시간 동안 소성하였다. Ni/Ru-K/Al2O3 펠렛 촉매는 직경 16 mm, 길이 20 mm, 7개의 원통형 통로를 가진 형태로 제작하여 반응표면적 증대와 원활한 유체의 흐름을 가지도록 하였다. 실험실 및 벤치 규모에 적용된 Ni/Ru-K/Al2O3 촉매들을 Figure 1에 나타내었다.
2.2.1. Lab-scale 개질 시스템
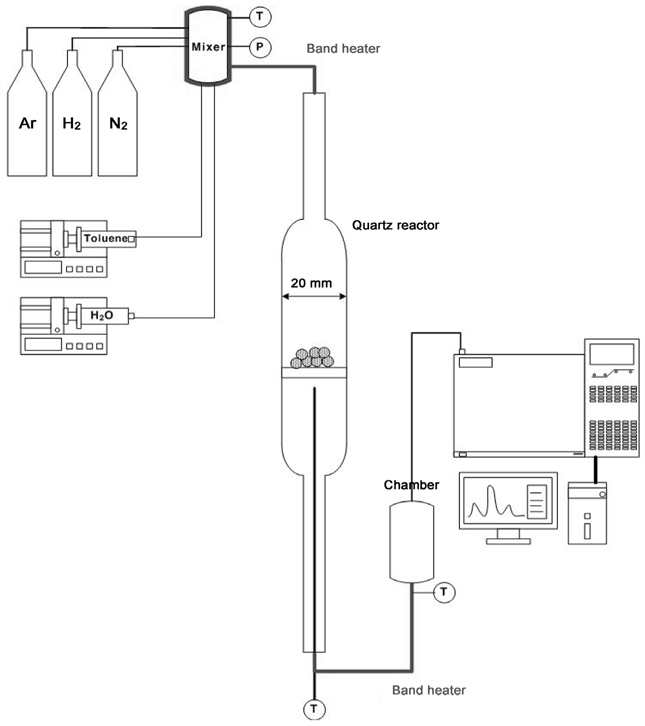
Figure 2는 lab-scale의 톨루엔 수증기개질 장치도이다. 반응기는 폭 20 mm의 석영으로 제작하였다. 250-500 µm 크기의 촉매가 반응기 중간에 위치하게 되며 공간속도(gas hourly space velocity, GHSV) 10,000 h−1를 기준으로 촉매의 양을 결정하였다. 톨루엔의 농도는 30 g/Nm3로 바이오매스 가스화시 생성되는 타르 농도인 5-75 g/Nm3를 고려하였다[3]. 수증기와 톨루엔의 몰 비(steam/fuel)는 25로 일정하게 유지하도록 각각 피스톤 펌프를 이용하여 정량적으로 주입하였다. 각각의 공급 라인은 밴드히터를 이용하여 250 ℃로 유지하여 기체 상태로 반응기로 공급되도록 하였다. 가스혼합기에서 이송가스인 질소와 기화된 톨루엔, 스팀이 만나 섞인 후 총 50 mL/min의 속도로 반응기에 주입되었다. 수증기개질 전 사용되는 촉매들은 H2:Ar 비율이 1:1인 가스를 50 mL/min 유량으로 800 ℃에서 2시간 동안 환원하였다. 톨루엔의 수증기개질로 인해 반응기로부터 생성된 가스는 가스크로마토그래피(HP 6890)로 유입되어, 열전도도검출기(thermal conductivity detector, TCD)와 불꽃이온화검출기(flame ionization detector, FID)를 이용하여 정량, 정성 분석하였다. 톨루엔의 전환율(Xc)은 다음 식으로 계산하였다.
주입한 비활성 기체인 질소로 가스크로마토그래피에서 분석된 전체 유량을 계산하여 각 물질별 몰 유량(V)을 계산하였다.
2.2.2. 벤치 규모 개질 시스템
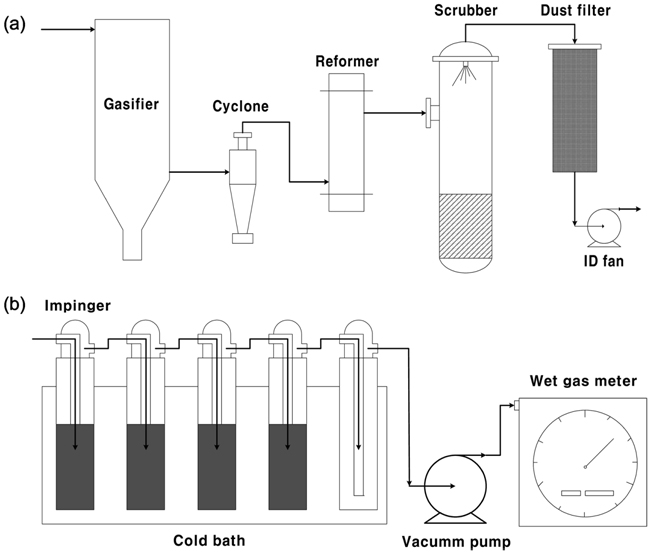
Figure 3(a)는 본 연구에서 적용된 1 톤/일 규모의 고정층 바이오매스 가스화 시스템의 도식도이다. 우드칩을 연료로 사용하였고, 안정적인 가스화를 위해 공기비(equivalence ratio)는 0.37을 유지하였다. 하향류식 고정층 가스화기를 사용하였으며 가스화기에서 생성된 합성가스는 사이클론을 통과하여 수트가 제거된 후 촉매 개질기로 유입되었다. 촉매 개질기 하부에서는 합성가스가 상향류로 유입되어 개질기내 유속 감소에 따라 수트가 추가로 제거되었다. 실험 조건에 따라 타르 개질기에 부착된 히터를 이용하여 저온에서 고온으로 변화시켰고, 실험 온도까지 가열된 촉매와 합성가스가 접촉하여 타르 수증기개질이 진행된 후 상부로 배출 되었다. 배출된 합성가스는 스크러버와 필터를 통과하여 굴뚝에서 연소되었다.
실험에 사용되는 모노리스 촉매는 부피당 담지되는 촉매의 양이 적고 비표면적이 작다. 또한 바이오매스 가스화시 발생되는 타르의 성분은 실험실 규모에서 쓰인 톨루엔보다 구성 물질이 다양하고 탄소 수가 많으므로, 실험에 쓰인 모노리스 촉매의 양은 실험실 규모 톨루엔 수증기개질보다 작은 공간 속도인 1,194 h−1을 기준으로 결정하였다. 펠렛 촉매의 경우 모노리스 촉매보다 표면적이 크고 부피당 활성점이 상대적으로 많으나, 실험실 규모 실험에 쓰인 파우더 형태의 촉매보다는 작은 활성이 예상된다. 따라서 펠렛 촉매의 양은 모노리스 촉매 실험의 공간속도와 실험실 규모 톨루엔 수증기개질 공간속도의 중간 값에 가까운, 공간속도 5,000 h−1를 기준으로 결정하였다. 사용한 펠렛 촉매는 재생을 위해 공기 중에서 800 ℃로 2시간 동안 연소하여 침적된 탄소를 제거하였다.
Figure 3(b)에는 바이오매스 가스화를 통해 생성된 가스 내 타르의 정량적 측정을 위한 장치 구성도를 보였다. 촉매 개질기 주입부와 출구에 각각 설치하여 합성가스 내 타르양을 측정한 후 개질기 전후 타르의 변화량을 통해 개질기에서의 조건별 타르 전환율을 계산하였다. 합성가스에 포함되어 있는 타르의 포집을 위해 5개의 임핀저로 구성되어 있으며 일정량의 이소프로판올을 임핀저에 주입하였다. 임핀저가 담긴 수조는 항온 순환 수조를 이용하여 3 ℃로 유지하였다. 펌프를 통해 흡입된 합성가스가 임핀저를 지나며 이소프로판올에 타르가 용해되고, 일정시간동안 타르를 포집 후 증발기에서 이소프로판올을 증발시켜 포집된 타르양을 측정하였다. 촉매 개질기 전후의 타르양 변화를 통해 각 촉매의 온도별 전환율을 다음의 식으로 계산하였다.
습식가스미터를 사용하여 임핀저를 통과한 합성가스의 부피를 측정하여 합성가스 부피당 타르의 양을 g/Nm3로 나타내어 위의 식에 대입하였다.
타르 개질 실험에서 쓰인 촉매의 탄소침적 저항성을 확인하기 위해 열중량분석(thermogravimetric analysis, Mettler-toledo 1600LF)을 수행하였다. 타르 개질을 수행한 촉매를 회수하여 공기 분위기에서 10 ℃/min으로 1,000 ℃까지 승온하며 촉매 표면에 붙어있는 탄소를 연소시켜 발생되는 질량의 변화를 측정하였다.
증진제에 따른 Ni 결정 크기에 대한 영향과 톨루엔 수증기 개질 및 펠렛 촉매의 재생 과정에서 결정 소결의 측정을 위해 X-선 회절(X-ray diffraction, Rigaku smartlab) 분석을 수행하였다. X-선 회절을 통해 분석된 결과는 Scherrer equation을 이용하여 Ni의 결정 크기 변화를 비교하였다.
톨루엔 수증기개질에서의 주요 반응은 다음과 같다[15, 17, 18, 25].
• Steam reforming reaction
• Water gas shift reaction
• Boudouard reaction
주입된 톨루엔은 Equation (3)과 (4)의 수증기개질반응에 의해 H2, CO, CO2의 가스로 전환되며, 이후 Equation (5)와 (6)에 의해 가스의 조성이 변화한다. Equation (5)와 (6)의 반응은 모두 발열반응으로, 고온에서 역반응이 진행된다[15, 25, 28].
3.1.1. Ni/Ru-X/Al2O3 촉매
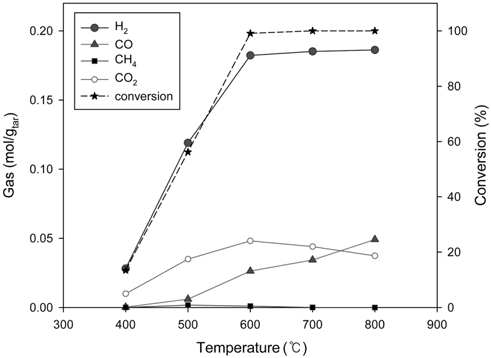
타르의 수증기개질에 효과적인 촉매를 찾기 위해 톨루엔을 모사 타르로 사용하여 실험실 규모 수증기개질을 수행하였다. Figure 4에는 Ni/Ru-Mn/Al2O3 촉매를 이용한 반응 온도 변화에 따른 톨루엔의 수증기개질 후 생성되는 가스 및 전환율 변화 결과를 보였다. 반응 온도가 증가함에 따라 H2, CO 생성량이 증가하였으며, CH4는 거의 생성되지 않았다. CO2 생성량은 증가와 감소를 보이며 600 ℃에서 최대치를 보였다. 600 ℃에서 톨루엔의 전환율은 99.1%에 도달하였으며 이때 H2의 생성량은 0.18 mol/gtar으로 수렴하였다. 톨루엔 전환율, H2 생성량의 수렴과 동시에 CO2 생성량의 감소는 기존 연구 결과에서도 유사한 경향을 볼 수 있다[15, 28, 29]. 600 ℃ 이후 전환율과 H2 생성량이 일정한 것을 고려했을 때 Equation (5)의 역반응은 CO 생성량의 증가와 CO2 생성량의 감소는 설명되나, H2가 감소하므로 적합하지 않다. 또한 Equation (3)과 (4)의 반응 선택도의 변화는 H2 생성량 또한 변화하게 되므로 결과의 해석에 적합하지 않다. 따라서 600 ℃ 이상의 온도에서 CO와 CO2 생성량의 변화는 Equation (6)의 역반응에 의한 것으로 판단된다[15, 28, 29].
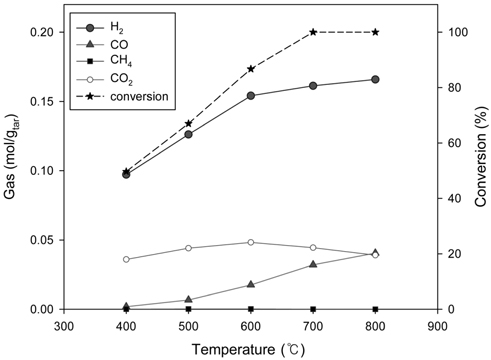
Figure 5는 Ni/Ru-K/Al2O3 촉매를 이용한 톨루엔 수증기개질 특성변화 결과를 나타내었다. Figure 4의 Ni/Ru-Mn/Al2O3 촉매를 이용한 결과와 유사하게 반응온도 증가에 따라 톨루엔 전환율, H2, CO 생성량이 증가하였으며 CO2 생성량 또한 소폭 증가와 감소를 보이며 600 ℃에서 최대치를 보였다. Ni/Ru-Mn/Al2O3 촉매 실험결과보다 높은 온도인 700 ℃에서 100% 전환율에 도달하였으며 400 ℃의 낮은 온도에서도 49.7%의 비교적 높은 전환율을 보였다. 곧, 본 연구에서 적용된 반응조건에서 Ni/Ru-K/Al2O3 촉매를 사용한 경우가 Ni/RuMn/Al2O3 촉매를 적용한 경우보다 600 ℃의 경우를 제외하고는 높은 톨루엔 개질효과를 보였다. Figure 5에서 H2와 CO2의 생성량은 600 ℃까지 온도 증가에 따라 함께 증가한다. 그러나 600 ℃ 이후 H2 생성량의 기울기가 줄어들며 H2 생성 증가량이 감소하고 CO2의 생성량 또한 감소한 것이 확인된다. 톨루엔 수증기개질 시 H2의 생성량에 영향을 주는 식은 Equation (3), (4), (5)이다. 그러나 Equation (4)와 (5)는 CO2의 생성량이 함께 증가하므로 Figure 5의 결과를 설명하기에는 적절하지 않다. 따라서 톨루엔 수증기개질에서 600 ℃ 이후의 H2의 주요 생성경로는 Equation (3)으로 판단된다[28].
3.1.2. 실험실 규모 촉매 특성 분석
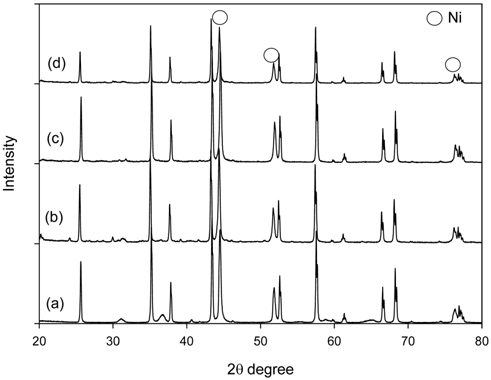
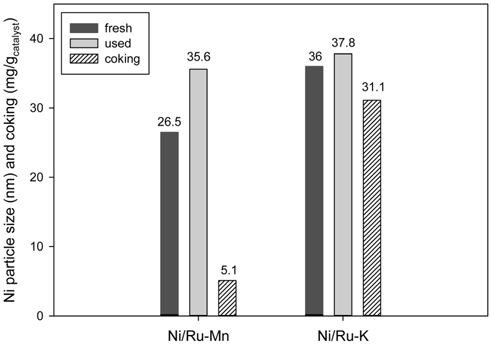
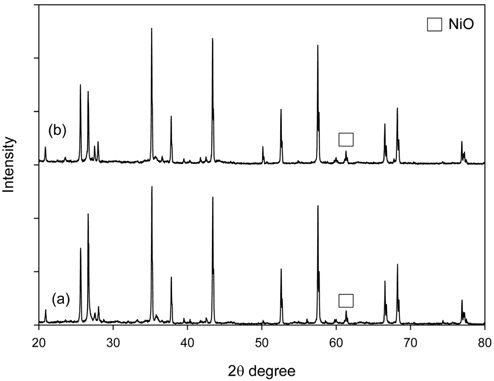
약 9시간의 온도별 톨루엔 수증기개질 후 사용된 촉매를 회수하여 X-선 회절분석과 열중량분석을 수행하였다. Figure 6은 톨루엔 수증기개질 전후 Ni/Ru-Mn/Al2O3와 Ni/Ru-K/Al2O3 촉매의 X-선 회절분석 결과이다. 사용 전 촉매와 톨루엔 수증기개질 후 촉매 모두 공통적으로 2θ = 44, 51, 76°에서 Ni peak가 관찰되었다. Ni peak 중 2θ = 51°에서 Scherrer equation[14, 28]을 이용하여 톨루엔 수증기개질 전후 촉매의 Ni 결정 크기를 계산하고, 열중량분석을 통해 촉매에 침적된 탄소의 양을 측정하여 Figure 7에 나타내었다. 톨루엔 수증기개질 후 촉매의 탄소침적양은 각각 5.1, 31.1 mg/gcatalyst로 Ni/Ru-Mn/Al2O3 촉매가 Ni/Ru-K/Al2O3 촉매에 비해 탄소침적에 대한 저항성이 큰 것을 확인할 수 있다. 또한 실험 전 Ni/Ru-Mn/Al2O3와 Ni/Ru-K/Al2O3 촉매의 Ni 결정 크기는 각각 26.5, 36 nm로 Ni/Ru-Mn/Al2O3 촉매의 Ni 결정크기가 더 작았다. 그러나 실험 후의 Ni 결정 크기는 35.6, 37.8 nm로 Ni/Ru-Mn/Al2O3 촉매의 경우 약 34% 증가하였다. 이러한 Ni 결정 크기의 변화는 소결에 의한 것으로 촉매 활성저하의 원인이 되며, 소결은 탄소침적보다 촉매 활성저하에 더 큰 영향을 준다[20, 28].
톨루엔 수증기개질 결과에서 Ni/Ru-Mn/Al2O3 촉매는 Ni/Ru-K/Al2O3 촉매에 비해 상대적으로 낮은 온도에서 톨루엔 전환율 100%에 도달하였으나, 장시간 운전 시 소결로 인한 촉매 활성 저하의 우려가 있다. 이에 반해, Ni/Ru-K/Al2O3 촉매는 400-500 ℃의 온도에서 Ni/Ru-Mn/Al2O3 촉매보다 높은 톨루엔 전환율을 보였다. 실제 가스화기에서 배출되는 합성 가스의 온도를 고려할 때, 낮은 온도에서의 높은 타르 전환율은 바이오매스 가스화 시스템으로의 적용에서 중요하다. 또한 Ni/Ru-Mn/Al2O3에 비해 Ni/Ru-K/Al2O3 촉매는 소결이 거의 관찰되지 않았으므로, 촉매의 안정성 면에서 유리하다.
실험실 규모 톨루엔 수증기개질 결과를 바탕으로 모노리스와 펠렛 촉매를 제작하고, 바이오매스 가스화기로부터 생성된 합성가스 내 타르 개질에 적용하였다. 가스화기 내부 온도는 850-1,000 ℃로 유지되었고, 생성되는 합성가스의 평균 유량은 64 Nm3/h이며, 조성은 H2 14-17%, CO 13-15%, CH4 1-3%, CO2 12-16%의 범위를 보였다.
3.2.1. Ni/Ru-X/Al2O3 모노리스 촉매
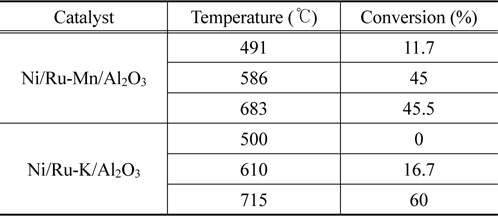
Ni/Ru-Mn/Al2O3와 Ni/Ru-K/Al2O3 모노리스 촉매의 온도별 타르 수증기개질 결과를 Table 2에 나타내었다. 모노리스 촉매에 담지된 Ni 양과 복합물질인 타르의 특성을 고려하여, 400 ℃의 낮은 온도에서는 타르 수증기개질이 어려울 것으로 예상하고 500 ℃부터 타르 수증기개질을 수행하였다. Ni/RuMn/Al2O3 모노리스 촉매는 491 ℃와 586 ℃에서 각각 타르 전환율이 11.7%와 45%로 개질기 온도 증가에 따라 증가하였다. 그러나 683 ℃에서는 개질기 온도 증가에도 불구하고 전환율의 변화가 거의 없는 45.5%가 관찰되었다. 이에 반해, Ni/Ru-K/Al2O3 모노리스 촉매는 500 ℃에서 타르 개질 효과가 보이지 않았으나, 온도가 증가함에 따라 타르 전환율이 증가하며 715 ℃에서 60%의 값을 보였다. 타르 수증기개질 후 열중량분석을 통해 확인한 Ni/Ru-Mn/Al2O3와 Ni/Ru-K/Al2O3 모노리스 촉매의 탄소침적양은 각각 2, 32 mg/gcatalyst으로, 실험실 규모의 경우와 유사한 결과를 보였다. Ni/Ru-Mn/Al2O3 모노리스 촉매의 경우 장시간 운전이 지속됨에 따라 683 ℃에서 전환율의 변화가 없었으며, 이는 탄소침적양이 Ni/Ru-K/Al2O3 모노리스 촉매보다 적음에도 불구하고 촉매의 활성이 감소한 것으로 보인다. Figure 6의 X-선 회절분석 결과에서 확인하였듯이, 톨루엔 수증기개질 후 Ni/Ru-Mn/Al2O3 촉매는 소결이 확인되었으며 소결은 촉매 활성저하의 주요 원인이다. 따라서 타르 수증기개질에서 Ni/Ru-Mn/Al2O3 모노리스 촉매의 활성 저하는 소결로 인한 것으로 판단되며, 활성 감소가 관찰된 Ni/Ru-Mn/Al2O3 모노리스 촉매보다 Ni/Ru-K/Al2O3 모노리스 촉매가 상대적으로 우수한 안정성을 가짐을 알 수 있다.
[Table 2.] Conversion of biomass tar over monolith catalysts
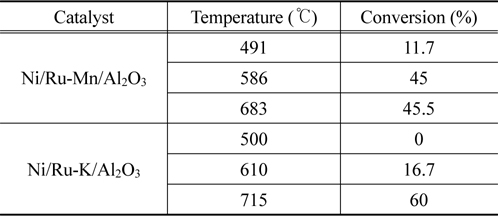
Conversion of biomass tar over monolith catalysts
앞선 실험실 규모의 톨루엔 수증기개질 결과와 비교하였을 때, 동일한 개질 온도에서 모노리스 촉매는 낮은 타르 전환율을 보였다. 이는 톨루엔과 같은 단일 성분이 아닌, 복합적인 탄화수소로 구성된 타르 개질의 어려움을 보여준다. 또한 톨루엔 수증기개질시 사용된 촉매의 분말 형태보다 모노리스 형태가 반응물과의 접촉면적이 상대적으로 작아, 낮은 타르 전환율이 관찰된 것으로 판단된다. 따라서 바이오매스 타르의 수증기개질시 사용되는 촉매는 장시간 운전에 따른 촉매 안정성과 더불어 촉매의 활성을 확보할 수 있는 적절한 촉매의 형태가 요구된다.
3.2.2. Ni/Ru-K/Al2O3 펠렛 촉매
Ni/Ru-X/Al2O3 모노리스 촉매 실험결과를 바탕으로, 타르 개질에 적합한 안정성을 위해 Ni/Ru-K/Al2O3을 사용하고, 모노리스 형태 대신 펠렛 형태로 제작하여 타르 개질을 수행하였다. 또한 6시간 동안 사용된 촉매를 공기 분위기의 800 ℃에서 2시간 동안 연소시켜 재생하고, 타르 개질을 수행하여 성능의 변화를 비교하였다.
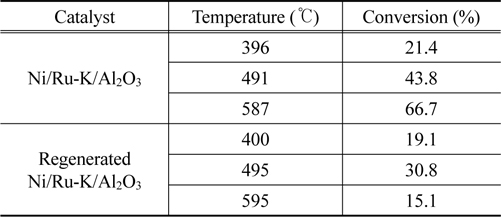
Table 3은 Ni/Ru-K/Al2O3 펠렛 촉매를 이용한 타르 개질 결과를 보였다. 펠렛 촉매는 모노리스 촉매보다 같은 부피에서 상대적으로 더 많은 Ni를 포함하므로, 활성이 더 클 것으로 예상하여 모노리스 촉매 실험 보다 낮은 온도 범위인 400-600 ℃에서 타르 개질을 수행하였다. Ni/Ru-K/Al2O3 펠렛 촉매는 396 ℃에서 타르 전환율 21.4%를 보였으며, 온도 증가에 따라 증가하며 587 ℃에서 66.7%의 전환율을 나타내었다. 반면 재생 촉매는 400 ℃에서 타르 전환율 19.1%가 관찰되어 새 펠렛 촉매의 결과와 유사했으나, 495 ℃에서 30.8%에 도달 후 감소하여 595 ℃에서 15.1%의 타르 전환율을 보였다. 곧, 재생 촉매는 500 ℃ 부근에서 재생 전 펠렛 촉매보다 낮은 전환율과 500 ℃ 이후 급격한 활성 감소가 관찰되었다. 활성 감소의 원인을 찾기 위해 새 촉매와 재생 촉매의 X-선 회절분석을 수행하여 Figure 8에 나타내었다. 가스화기와 연계한 타르 개질 시 펠렛 촉매는 사용 전 환원을 하지 않기 때문에 NiO의 결정 크기를 계산하였다. 새 촉매와 재생 촉매의 NiO 결정 크기는 2θ = 61°에서 각각 87.5와 130.4 nm로 나타났으며 타르 개질 및 재생 과정 동안 촉매의 NiO 결정 크기가 49% 증가한 것으로 확인된다. 이는 곧, 장시간 고온에 노출된 촉매의 NiO가 소결되어, 재생 후 촉매의 활성이 저하된 것으로 판단된다.
[Table 3.] Conversion of biomass tar over fresh and regenerated Ni/Ru-K/Al2O3 pellet catalysts
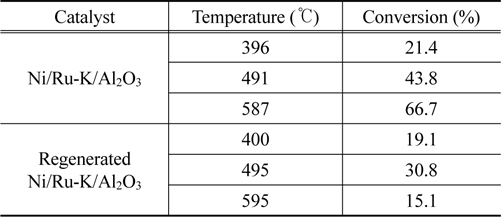
Conversion of biomass tar over fresh and regenerated Ni/Ru-K/Al2O3 pellet catalysts
전 온도영역에서 Ni/Ru-K/Al2O3 펠렛 촉매는 모노리스 촉매보다 높은 타르 전환율을 나타내었으며, 재생 후에도 500 ℃까지 모노리스 촉매보다 높은 전환율을 보였다.
고정층 바이오매스 가스화 시스템에 적용 가능한 타르 개질 촉매 제작을 위하여 실험실 규모와 벤치 규모의 타르 개질을 수행하였다. Ru, Mn, K를 촉진제로 첨가하여 Ni/Ru-Mn/Al2O3, Ni/Ru-K/Al2O3 촉매를 제작하였다. 모사 타르인 톨루엔의 수증기개질을 실험실 규모에서 온도 영역별로 수행하였고, Ni/Ru-K/Al2O3 촉매의 저온에서 높은 활성과 내구성을 확인하였다. 실험실 규모 실험 결과를 바탕으로 모노리스와 펠렛 형태로 촉매를 제작 후 벤치 규모 고정층 바이오매스 가스화기와 연계하여 타르 개질을 수행하였다. Ni/Ru-Mn/Al2O3 모노리스 촉매는 타르 개질 시 활성 감소가 관찰되었고, Ni/Ru-K/Al2O3 모노리스 촉매는 활성 감소 없이 715 ℃에서 60%의 타르 전환율에 도달하였다. Ni/Ru-K/Al2O3 펠렛 촉매는 전 온도 영역에서 모노리스 촉매보다 높은 전환율을 보이며 587 ℃에서 전환율 66.7%에 도달하였고, 촉매의 활성 저하는 관찰되지 않았다. 사용된 Ni/Ru-K/Al2O3 펠렛 촉매는 재생 후 495 ℃에서 타르 전환율 30.8%을 보였으나, 이후 촉매의 활성 저하가 관찰되었다. 결론적으로, 우수한 성능과 높은 안정성을 보인 Ni/Ru-K/Al2O3 펠렛 촉매가 고정층 바이오매스 가스화 시스템의 타르 개질 시 적합한 촉매임을 확인하였다.