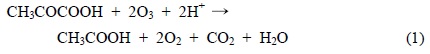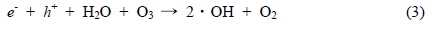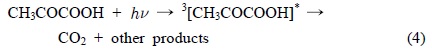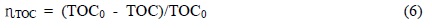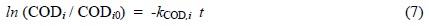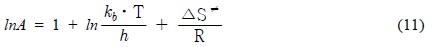Ozonation was investigated for its ability to remove pyruvic acid in a laboratory-scale batch reactor under various experimental conditions, including UV irradiation, TiO2 addition, and variations in temperature. An ozone flow rate of 1.0 L min-1 and a concentration of 75±5 mg L-1 were maintained throughout the experiment, and pH, COD, and TOC were measured at 10 min intervals during a 60 min reaction. Our results confirmed that the combination of UV irradiation and photocatalytic TiO2 in the ozonation reaction improved the removal efficiency of both COD and TOC in aqueous solution at 20℃. Pseudo first-order rate constants and activation energies were quantified based on the COD and TOC measurements. We observed that the O3/UV, O3/UV/TiO2 system increased mineralization and reduced the activation energy (
오존산화 처리의 응용성은 물과 폐수에 존재하는 오염물질의 제거, 매립지 침출수 처리(Jeong and Jeong, 2005), 피혁 염색폐수의 색도저감(Yoon et al., 2013) 그리고 용존 중금속 제거(Seo et al., 2010) 등 매우 광범위해지고 있으며 이와 관련된 연구가 활발하게 진행되고 있다. 오존은 방향족 고리 화합물, 이중결합 그리고 아민 및 황 성분을 포함하는 여러가지 물질과 반응하므로(Camel and Bermond, 1998; Qiang et al., 2004) 물과 폐수에 존재하는 유기 오염 물질을 제거하기 위해 널리 사용되어 왔다.
유기물질들 중에서 특히 저분자 유기산, 케톤 그리고 알데히드와 같은 오존산화 부산물들은 오존과 반응하기 어렵기 때문에(Kasprzyk-Hordern et al., 2003; Qiang et al., 2010) 이와 같은 유기화합물질들이 공존하는 경우 오존처리에 의하여 오염물질을 분해시키기가 매우 어렵다. 피루브산(Pyruvic acids, PA)은 수중에 용해되어 있는 유기 화합물 및 천연 유기 물질들의 오존산화반응이 진행되는 동안 생성되는 중요한 중간생성물 중 하나로서, 단독 오존산화처리의 분해 반응 속도가 매우 느린 것으로 발표되었다(Beltrán et al., 2007).
Andreozzi 등(Andreozzi et al., 1998; Andreozzi et al., 2001)은 PA가 오존에 대해 산화저항력이 크기 때문에 단독 오존산화반응에 의한 매우 느린 분해속도를 증가시키기 위한 방안으로, MnO2를 첨가하면 용존 Mn2+ 및 Mn4+가 균일 촉매로 작용하여 분해 반응이 촉진되며 처리공정의 효율을 향상 시킬 수 있는 것으로 보고하였다. 그러나 금속이온들을 이용한 균일계 오존산화 반응의 경우 반응 후 촉매의 회수가 불가능하며 이를 처리하기 위한 추가적인 공정이 필요하다. 최근, 오존에 의한 PA의 분해를 촉진시키는 불균일 촉매로는 Co/Al2O3 (Alvarez et al., 2007), CuO/ ZrO2-Al2O3 (Hofmann et al., 2005) 그리고 perovskite (LaTi0.15Cu0.85O3) (Rivas et al., 2006)가 보고되었다. 불균일 촉매의 경우 대부분의 촉매가 강산성 용액에서 용해되기 쉽기 때문에, 다양한 유기오염물질을 효과적이고 안정적으로 제거하기 위한 다양한 연구들이 시도되고 있다.
고도산화공정(advanced oxidation processes, AOPs)은 유기물질과 비선택적으로 반응하여 분해 및 무기화에 유리한 ·OH(히드록실 라디칼)의 생성과 활성에 기반을 두고 있으며 TiO2광촉매/오존, UV/과산화수소를 조합한 복합 오존산화, wet 산화처리, 펜톤처리, 오존/과산화수소 등과 같은 화학적 산화공정들이 연구되고 있다(Pera-Titus et al., 2004). TiO2는 높은 광촉매적 활성과, 저 환경부하 그리고 낮은 독성 때문에 다양한 난분해성 독성물질들을 분해시키기 위하여 널리 사용되어왔다. 또한 TiO2광촉매 반응이 진행됨과 동시에 오존과 TiO2가 반응하여 촉매작용이 활성화되는 것으로 발표하였다(Pichat et al., 2000). 그러나 오존산화에 의하여 난분해성인 PA 처리에 관한 연구는 매우 부족한 실정이다.
본 논문에서는 오존의 산화력과 TiO2의 광촉매 특성을 조합한 O3, O3/UV, O3/TiO2/UV시스템을 구성하여 피루브산의 분해반응을 수행하였고, 실무에 적용할 수 있는 기초자료를 마련하기 위하여 반응과정에서 변화하는 pH, COD 그리고 TOC에 기초하여 반응속도론적 연구를 수행하였다.
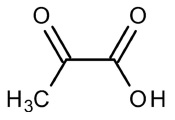
실험에 사용한 pyruvic acid (PA, 99.0%, Sigma-Aldrich co.)는 분자량 88.06, 밀도 1.267 g mL-1, 융점 11~12℃, 비등점 165℃이고 산해리상수 K값이 3.2×10-3 (25℃)인 액체이다. Fig. 1에 PA의 분자 구조를 나타내었다. TiO2 (98.5%, Rhodia co.)는 아나타제 결정상이고 입자크기 15~30 nm, 비표면적 70~90 m2 g-1 제품을 구입하여 사용하였다.
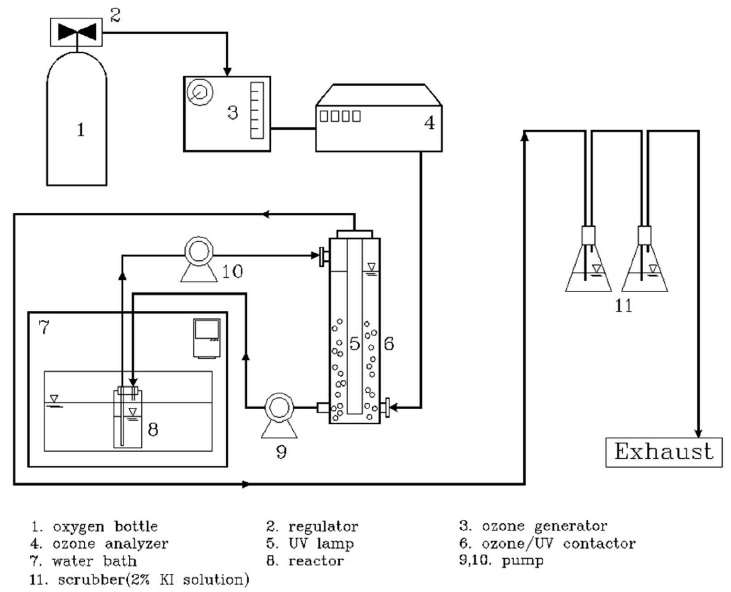
오존발생장치는 전기방전에 의하여 오존을 발생시키는 Ozonetech사의 LAB-1을 사용하였다. 생성된 오존은 오존분석기(Okitrotec co., OZM-7000GN, Japan)로 통과시켜 오존 농도를 측정하였고 오존분석기를 통과한 가스는 PA 시료가 포함된 반응조로 유입시켰다. 가스의 유량은 1.0 L min-1, 오존농도를 70±5 mg L-1로 유지하였다. O3/UV 반응기는 내경 8 cm, 높이 85 cm, 유효수심 80 cm, 그리고 유효부피 4.0 L 되게 제작하였다. 용반응기 저부에는 기-액 접촉효율을 높이기 위해 기체분산노즐을 설치하였다. UV 시스템은 254 nm 파장의 자외선원으로 39 W의 Phillips사 제품 저압수은 램프(low pressure mercury lamp)를 사용하였다. 광원직경은 1.5 cm, 길이 77 cm이고, 직경 2 cm 석영관 내부의 설치하여 반응기 포함된 용액과 평균조사거리 1.625 cm로 직접 접촉시켰으며, UV강도는 3.56×10-2 W cm-2 항온 water bath(Daihan Scientific Co., WiseCircuTM) 내부에 반응기를 넣어 온도를 조절하였다. 반응 후 잔여 가스는 2% KI용액이 든 2개의 스크러브를 통과시켜 배오존 가스를 제거하였다. 오존 산화장치 개요도를 Fig. 2에 나타내었다.
본 실험에서는 100 mg L-1 (1.13 mM) 농도로 제조한 피르부산 용액 4L에 99% 이상의 고순도 산소를 사용하여 발생시킨 오존을 통과, 0.075 g L-1의 TiO2 첨가 및 UV 조사를 각각 조합하여 진행하였다. 20℃에서 60분 동안 반응을 진행하였으며, pH, COD 그리고 TOC의 변화를 10분 간격으로 측정하였다. 또한 반응온도에 따른 공정들의 효율 변화를 알아보기 위해 10℃, 30℃에서 실험을 진행하였다.
pH는 측정기는 Orion co., 3 STAR를 사용하여 측정하였으며, pH 측정은 Samchun Pure Chemical사의 buffer solution pH 4.0, pH 7.0 pH 10.0을 사용하여 보정을 한 후 채취한 시료의 pH를 측정하였다. COD (Chemical Oxygen Demand)는 Standard Method의 과망간산칼륨(KMnO4)법으로 수행하였다. TOC는 Shimadzu co., TOC-V CPH를 사용하여 측정하였다.
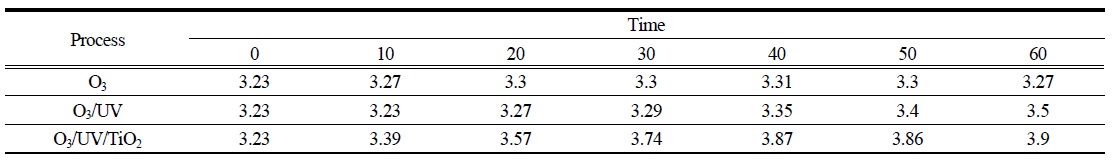
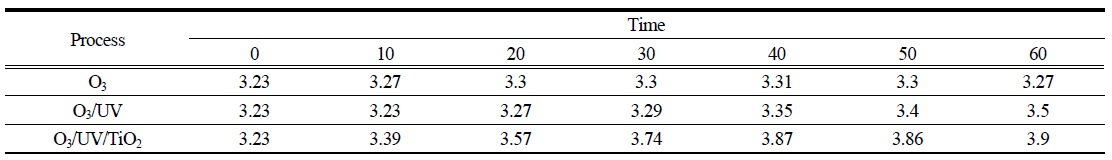
20℃에서 O3, O3/UV 그리고 O3/UV/TiO2 시스템을 사용하여 PA 수용액의 반응이 진행되는 동안 pH 값을 측정하여 Table 1에 나타내었다. 반응 전의 PA 수용액은 산성(pH=3.23)으로 나타났으며 TiO2 첨가 후에도 변하지 않았다. 이와 같은 결과를 통하여 오존 단독 산화반응 시스템에서 60분 동안의 반응 후에도 PA가 크게 저감되지 않았음을 예측할 수 있다. O3/UV 및 O3/UV/TiO2 조합 오존산화 처리 공정에서는 pH가 시간에 따라 증가하는 경향을 보였다. 특히 O3/UV/TiO2 산화공정의 경우에는 반응이 진행되는 40분 동안 가장 많이 pH는 증가한다. Rivas 등(Rivas et al., 2006)은 perovskite 촉매를 이용하여 PA의 오존산화 반응을 수행한 결과, TOC제거 및 PA가 분해가 되는 동안 아세트산(acetic acid)이 주성분이고 옥살산 등이 중간생성물로 존재하고 있음을 확인하였다. 그리고 Alvarez등의 연구(Alvarez et al., 2007)에 따르면, PA의 촉매 오존산화반응이 진행되는 동안 아세트산이 주된 중간생성물이고, 식 (1), (2)을 거쳐 PA가 분해된다고 발표하였다.
[Table 1.] Variations in pH during the oxidation of PA at 20℃.
Variations in pH during the oxidation of PA at 20℃.
위의 식 (2)에 나타난 바와 같이 PA와 오존의 산화 반응이 진행되는 동안 H+의 소모가 이루어진다. 또한 반응물인 PA의 산해리상수(pKa)는 2.5이고 생성물인 아세트산의 산해리상수가 4.75로써 더 약한산이다. 그러므로 산화반응이 진행되어 생성물이 증가할수록 용액에 존재하는 [H+]는 감소하게 되고 pH는 증가될 것이다.
PA와 TiO2에 흡착됨으로써 용존된 PA의 농도에 미치는 영향을 파악하기 위하여 PA(100 mg L-1) 용액에 TiO2를 5.00 g L-1가 되도록 첨가한 후 60분 동안 교반시켜 흡착실험을 실시하였다. 실험결과 COD 및 TOC 농도 값이 변화하지 않는 것으로부터 TiO2에 의한 PA의 흡착 정도는 무시할 정도로 나타났으므로 산화반응의 연구에 사용되는 COD와 TOC의 농도는 흡착에 의한 농도 보정은 실시하지 않았다.
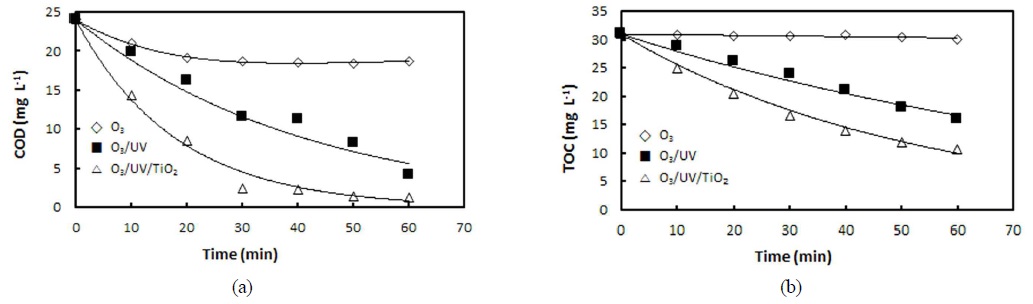
20℃에서 O3, O3/UV 그리고 O3/UV/TiO2 시스템에서 PA의 산화반응이 진행되는 동안 변화하는 COD 및 TOC의 측정치를 Fig. 3에 나타내었다. PA의 오존 산화처리를 60분 동안 반응시킨 후에 COD와 TOC의 제거율은 오존 단독처리의 경우에는 22.0%, 2.79%, O3/UV 시스템의 경우 82.49%, 48.5%, O3/UV/TiO2 시스템의 경우 94.5%, 65.4%인 것으로 나타났다. Kasprzyk-Hordern et al. (2003)과 Qiang et al. (2010)은 PA가 오존 단독 산화반응에 의해서 분해하기는 어렵다고 보고된 결과와 본 연구의 실험결과는 일치한다. O3/UV/TiO2 산화공정의 경우에는 초기 30분의 경우 90% 정도 COD의 값이 감소한 것으로 나타난 것으로부터 O3/UV/TiO2 시스템이 PA를 효과적으로 분해시키는 것을 알 수 있다.
Al-Ekabi 등의 연구(Al-Ekabi et al., 1993)에 따르면 TiO2의 광촉매 반응에서 VB (valence band)와 CB (conduction band)에서 각각 생성되는 정공(
또한 Grgic 등(Grgić et al., 2010)은 PA와 옥살산이 도입된 혼합물 수용액에서 O3/UV 광화학반응 시스템에서 산화 반응을 수행한 결과, Guzmann (Guzman et al., 2006)이 발표한 식 (4)와 같이 광유도 소중합체화 반응에 따라 PA가 분해되고, 여기된 PA의 삼중항상태는 더 많은 광화학반응을 일으킬 수 있는 충분한 에너지를 제공한다고 발표하였다. 따라서 PA가 오존과 반응하여 분해되는 반응경로에 포함시킬 수 있다.
따라서 PA의 산화반응이 O3/UV 시스템에서 오존 또는 UV조사에 의해 반응이 진행되어 생성되는 중간생성물인 옥살산과 수용액에 존재하는 감광제(photosensitizer)인 수용액에 존재하는 PA가 소중합체화 되는 반응이 복합적으로 활성화됨으로써 PA 수용액 중에 포함된 COD 및 TOC의 제거율은 증가하게 될 것이다. 더욱이 O3/UV/TiO2 시스템의 경우, 광촉매 반응에 의해 ·OH이 추가적으로 작용하여 PA의 분해를 강력하게 촉진시키는 것으로 설명할 수 있다.
산화공정에 의한 COD와 TOC 성분 농도의 변화는 처리공정에서 산화 반응 및 무기화 반응의 진행정도를 판단하는 지표로 사용된다. 또한 TOC/COD 비율은 대상 유기물의 특성에 따라 다르므로 다양한 대상물질들의 연구를 통해 COD와 TOC의 상관관계가 확립된다면 TOC/COD의 변화를 통해 분해과정의 전반적인 반응경향을 이해할 수 있는 자료로서 활용이 가능하다(Eckenfelder, 1989).
PA의 오존 산화반응 특성을 파악하기 위하여 UV 조사와 TiO2를 첨가한 O3, O3/UV 및 O3/UV/TiO2 시스템을 구성하여 실험을 진행하였다. 그리고 산화 반응과 무기화 반응의 상대적인 비율을 구하기 위하여 각각의 반응 시스템에서 산화반응이 진행되는 동안 10분 간격으로 상등액을 채취하여 분석한 COD 및 TOC 측정값으로부터 COD 분해율, ηCOD와 TOC 분해율, ηTOC를 식 (5), (6)에 의하여 각각 구하였다.
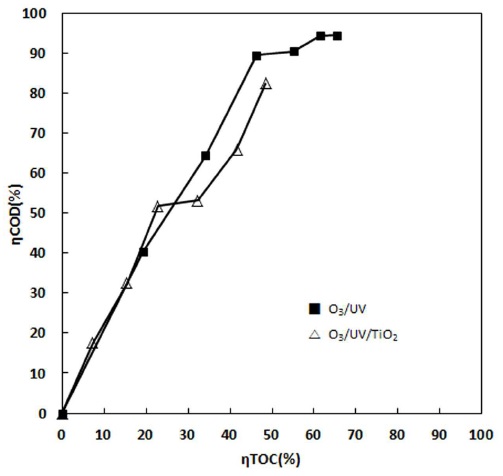
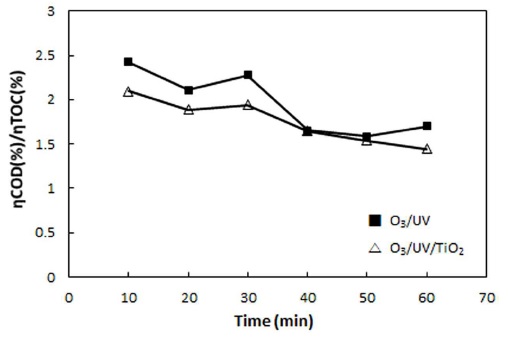
O3/UV, O3/UV/TiO2 시스템을 사용하여 20℃에서 PA의 오존산화 반응을 수행한 COD, TOC 실험값으로 부터 계산된 산화 반응과 무기화 반응의 상관관계, ηCOD/ηTOC를 Fig. 4에 나타내었다. 반응이 진행되는 동안 산화 반응과 무기화 반응의 상대적인 비율을 나타내는 ηCOD/ηTOC 변화를 계산하여 Fig. 5에 나타내었다. Fig. 5에 나타난 바와 같이 20℃에서, 단독 O3, O3/UV 그리고 O3/UV/TiO2 시스템의 경우 산화 반응과 무기화 반응의 상대적인 비율(ηCOD/ηTOC)의 값이 단독 O3 시스템의 계산값 ηCOD/ηTOC을 7.91 (Fig. 5에 별도로 표시하지 않았음)로 매우 큰 값을 나타내었다. 그리고 O3/UV 그리고 O3/UV/TiO2 시스템의 계산값 ηCOD/ηTOC은 1.70과 1.45로써 1보다 크게 나타났다. 이와 같이 산화 반응과 무기화 반응의 상대적인 비율이 1보다 크게 나타난 것은 PA가 분해되는 산화 반응 및 무기화 반응의 진행에 있어서 산화반응이 더 우세하게 진행되고 있음을 알 수 있고 O3/UV/TiO2, O3/UV 그리고 단독 O3, 시스템 순서로 무기화 반응 진행 정도가 큼을 알 수 있다. 그리고 단독 O3, O3/UV 및 O3/UV/TiO2 시스템에서 전반적으로 반응초기에 오존의 직접산화 반응에 의해 PA가 분해됨에 따라 초기 산화반응이 우세하지만, 반응이 진행됨에 따라 PA가 분해되면 중간생성물인 옥살산, 아세트산을 거쳐 CO2가 생성되며 이와 같은 과정에는 O3의 직접 산화반응, ·OH 라디칼이 PA를 포함한 중간생성물들과 복합적으로 반응한 결과로 판단된다.
O3 산화반응에 UV 조사와 TiO2가 첨가되여 촉매작용이 활성화되면 오존성 라디칼의 증가하게 되고 생성된 ·OH 라디칼이 반응초기부터 PA 및 중간생성체를 비선택적으로 공격하는 강한 산화 반응이 진행될 것이다. 특히 O3/UV/TiO2 시스템의 경우 ηCOD/ηTOC의 비율이 반응초기부터 1에 가까운 값을 나타내는 것은 산화반응과 무기반응이 동시에 촉진되어짐과 동시에 ηTOC가 크게 증가하여 ηCOD/ηTOC의 비율이 반응초기부터 1에 가까운 값을 나타낸 것으로 판단할 수 있다.
반응속도상수의 계산은 Shiyun 등(Shiyun et al., 2003)이 물질의 분자에너지와 COD제거율, 반응 속도론적 관계를 이용하여 유사일차반응을 유도한 방법을 사용하였다.
오존산화반응이 진행되는 동안 화합물들은 많은 중간생성물(intermediate)을 생성시킨다. 이것은 단순히 오존분자에 의한 산화반응이 아닌 ·OH이 초기화합물과 모든 중간생성물과 반응하며, 최종생성물로 CO2와 H2O가 생성되기 때문이다. 오존산화반응에서 화합물i와 모든 중간체를 포함한 반응물의 종합적인 반응속도가 유사 1차 반응으로 진행된다면 식 (7)이 된다(Lee and Kim, 2010).
같은 방법으로 TOC 제거율에 기초한 반응속도식을 적용하면 식 (8)이 된다.
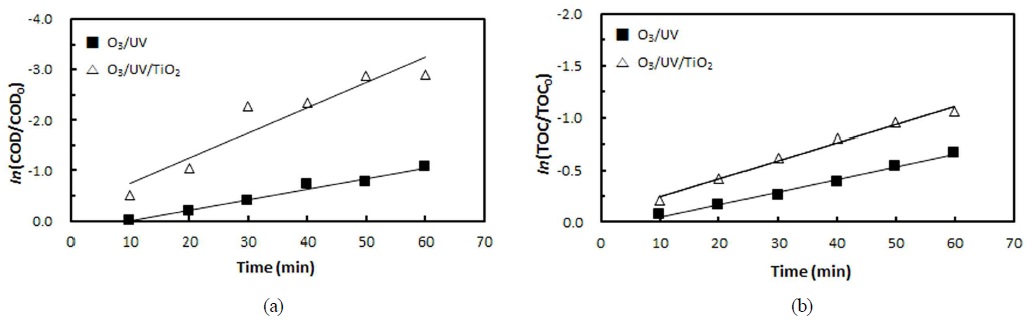
Fig. 6에 20℃에서 오존분해 반응이 진행하는 동안 시간에 따른 PA의
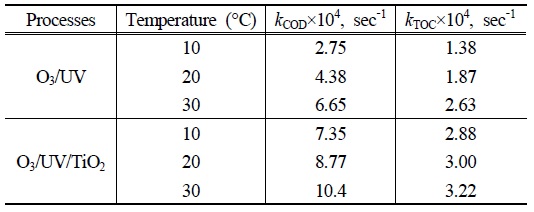
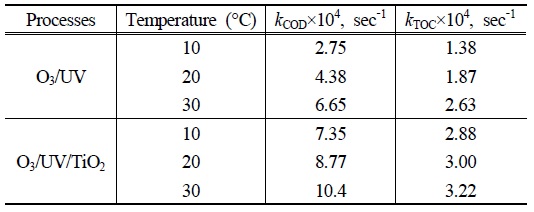
본 논문에서 수행된 산화반응들의 온도 영향성을 알아보기 위하여 10℃, 20℃ 그리고 30℃에서 동일한 조건의 실험을 진행하였으며 각각의 COD제거 속도 상수와 TOC 제거 속도 상수를 구하여 Table 2에 나타내었다. 본 실험의 조건에서는 각각의 실험결과 온도가 증가함에 따라
[Table 2.] kCOD and kTOC during O3/UV and O3/UV/TiO2 degradation of PA at different temperature
kCOD and kTOC during O3/UV and O3/UV/TiO2 degradation of PA at different temperature
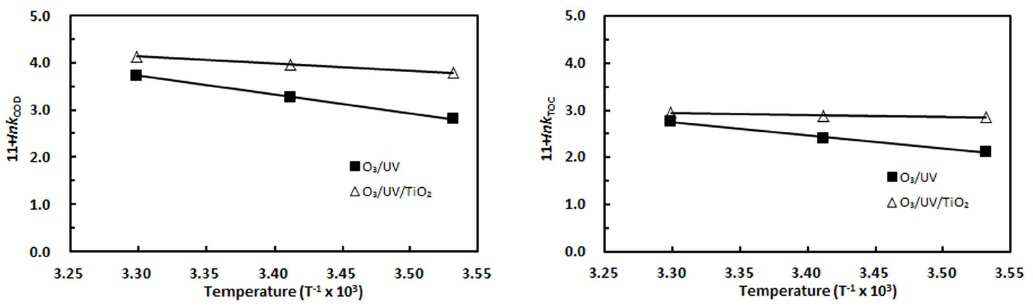
10℃, 20℃ 그리고 30℃에서 구한 각각의 반응속도 상수로부터 Arrhenius 식 (9)을 사용하여 활성화 에너지(
여기서
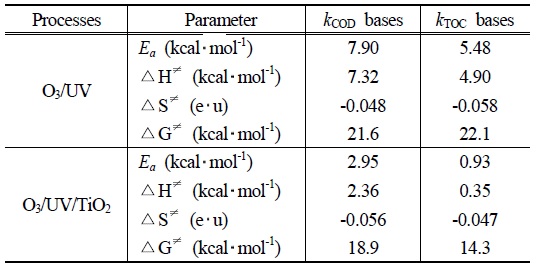
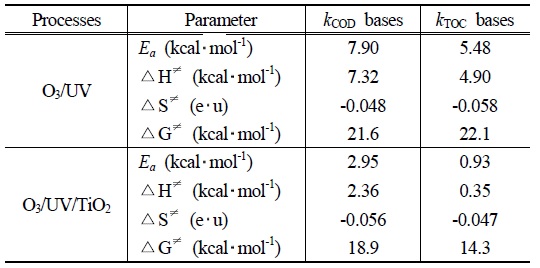
[Table 3.] Activation parameter for the Oxidation of PA with O3/UV and O3/UV/TiO2.
Activation parameter for the Oxidation of PA with O3/UV and O3/UV/TiO2.
Table 3에 나타난 바와 같이 PA가 O3/UV 시스템의 반응에서
본 연구에서는 유기 화합물 및 천연 유기 물질들의 오존산화반응이 진행되는 동안 생성되는 주요 중간생성물 중 하나인 PA를 효율적으로 처리하기위한 오존산화반응에 대하여 연구하였다. PA 용액에 순수한 O3 (75±5 mg mL-1)를 1.0 L min-1로 통과하여 O3, O3/UV, O3/UV/TiO2를 조합한 산화반응 시스템을 구성하여 수행한 연구결과는 다음과 같다.