In this study, we synthesized a combination of graphene oxide (GO) and titanium dioxide (TiO2) and confirm that GO can be used for CO2 photoreduction. TiO2 exhibited highly efficient combination with other conventional electric charges generated by these paration phenomenon for suppression of hole-electron recombination. This improved the efficiency of CO2 photoreduction. The synthetic form of GO-TiO2 used in this study was agraphene sheet surrounded by TiO2 powder. Efficiency and stability were enhanced by combination of GO and TiO2. In a CO2 photoreduction experiment, the highest CO conversion rate was 0.652 μmol/g·h in GO10-TiO2 (2.3-fold that of pure TiO2) and the highest CH4 production rate was 0.037 μmol/g·h in GO0.1-TiO2 (2.4-fold that of pure TiO2). GO enhances photocatalytic efficiency by functioning as a support and absorbent, and enabling charge separation. With increasing GO concentration, the CH4 level decreases to~45% due to decreased transfer of electrons. In this study, TiO2 together with GO yielded a different result than the normal doping effect and selective CO2 photoreduction.
온실가스로 널리 알려진 이산화탄소(CO2)의 변환은 온실가스 저감과 동시에 유용물질의 생성이라는 측면에서 다양한 방면으로 연구가 진행 중이다(Song, 2006). 그 중 대표적인 방법으로 암모니아와의 반응을 통한 요소의 합성이라든지 알코올과의 반응을 통한 카르보네이트의 합성이 있다(Spinner, 2012). 이러한 합성 방법들은 다른 물질과 더불어 높은 압력, 온도를 요구한다. 따라서 온실가스의 감소 측면에서 전체적인 CO2 발생을 고려하면 효율향상을 위해 여전히 많은 연구가 필요한 분야이다(Song, 2006). 또 다른 CO2의 변환 방법으로 CO2의 수소화반응이 있다(Upadhye et al., 2015). 강력한 환원력을 가진 수소를 이용하여 CO2를 역수성가스 반응을 통해 변환시킬 수 있다(Hu et al., 2013). 하지만 안정적인 CO2 분자의 화학결합을 파괴해야 하기에 높은 에너지를 요구하며 수소공급 측면, 높은 운영비용과 불안전성으로 아직 실용화하기에는 많은 단계들이 남아있다. 뿐만 아니라 이러한 방법들은 한해 약 35.3 Gt 발생되는 CO2의 저감을 위한 대규모 적용에는 부족한 점들이 많다(Olivier et al., 2014; Zhao et al., 2013). 이러한 어려움을 극복하는 방안으로 광촉매를 이용한 CO2의 광환원이 효과적인 대안으로 각광을 받고 있다(Liu, Hoivik et al., 2012). 이는 빛에너지 외에 추가적인 에너지를 필요로 하지 않으며 상온상압에서도 반응 진행이 가능한 친환경적인 방법이기 때문이다.
다양한 광촉매 물질 중에서 이산화티타늄(TiO2)이 가장 보편적인 연구 대상이다(Gaya and Abdullah, 2008; Zhao et al., 2013). 단순 TiO2는 홀-전자 재결합 현상, 광활성의 저감 현상으로 실제 적용에는 한계가 있다. 이러한 약점을 극복하기 위해 다른 물질과 조합하는 방법이 효과적인 방법이며 이를 통해 광활성 및 수율을 향상시킬 수 있다(Kim et al., 2014; Lee et al., 2010; Nasution et al., 2005; Yui et al., 2011). 최근에 그래핀은 높은 전기전도율, 커다란 비표면적, 훌륭한 열전도도 등 기존 물질에서는 보기 힘든 다양한 특성을 가지고 있기에 다양한 방면에서 주목을 받는 탄소나노물질이다(Shao et al., 2010). TiO2를 훌륭한 성질을 가진 그래핀과 결합한다면 좋은 시너지 효과를 거둘것으로 예측되지만 그래핀의 낮은 반응성과 응집현상으로 결합이 용이 하지 않다(Jiang et al., 2011; Park, 2013).
그래핀 옥사이드(GO)는 그래핀이 산화된 형태로 그래핀 탄소 시트에 다양한 산소작용기가 결합된 형태이다. 이러한 산소작용기를 통해 탄소 시트와 다른 물질과 연결이 가능하다. GO에 존재하는 주요 산소작용기인 카르복실기와과 수산화기는 전자전달에 좋은 연결고리이기에 GO와 TiO2가 좋은 시너지 효과를 얻을 수 있을 것으로 예상된다. 뿐만 아니라 GO는 기체 흡착능을 향상시킬 수 있으며 CO2 흡착에 높은 성능을 가진 것으로 알려져 있다(Garcia-Gallastegui et al., 2012; Sayama et al., 2000). 기존의 연구에서는 전도율을 향상시키기 위하여 GO를 환원된 형태로 많이 적용되었으나, 환원되지 않은 GO로 홀-전자 재결합 현상을 줄일 수 있어 조합을 통한 광촉매 효율 향상을 기대할 수 있다(Gao et al., 2014). Hsu et al. (2012)은 GO가 광촉매와 비슷한 성질을 가져 GO만으로도 CO2를 환원시킬 수 있다고 연구 결과를 발표한 바가 있다.
본 연구에서는 환원되지 않은 GO와 나노 TiO2의 조합을 통해 CO2의 광환원 실험을 실시하였다. GO의 적용으로 순수 TiO2만 광촉매 반응에 적용시 발생되는 문제인 홀-전자 재결합 현상 저하현상을 극복하고자 하며, 나노 TiO2를 GO와의 조합을 통한 표면적 증가를 통한 광촉매 반응의 효율 향상을 이루고자 한다. 이전 연구에서 GO와 TiO2의 조합 및 광촉매 산화반응을 통한 성능 향상을 확인한 바가 있다(Gao et al., 2014). 하지만 본 연구에서처럼 환원반응에 적용한 연구는 거의 없다. 또한 기존 연구에서 많이 다루어진 환원된 GO의 적용 대신에 환원되지 않은 GO을 TiO2와 조합하고자 한다. 이러한 GO와 TiO2 조합을 통해 CO2 광환원으로 생성되는 물질을 측정하여 두 물질이 CO2 광환원에 좋은 조합임을 증명하고자 한다.
본 연구에 나노 TiO2는 졸겔법으로 합성하였다(Yu et al., 2012). 9.2 g의 titanium isopropoxide (above 98%, Deajung)를 30 ml의 순수한 에탄올(absolute, Deajung)에 녹였다. 이를 10분간 교반한 후에 150 ml의 탈이온수에 한 방울씩(dropwise) 투입하였다. 이렇게 생성된 분말을 원심분리로 모은 후 탈이온수와 에탄올로 각각 3 차례 세척하였다. 세척된 분말은 오븐에서 100℃로 충분히 말린 후 400℃에서 3시간동안 하소하였다(ramp rate 1℃/분).
앞서 졸겔법으로 합성된 나노 TiO2에 GO (sigma aldrich)를 투입하여 합성하였다. 90분간 초음파 처리(SD-200D, 40 kHz, 100 W)한 후 12시간동안 교반시켰다. 생성된 현탁액은 오븐에서 100℃로 충분히 말렸다. 투입비는 TiO2 대비 GO의 0.1, 1, 5, 10% 중량비로 투입하여 얻었다. 이렇게 얻어진 물질은 GOX-TiO2이며 X는 각각 0.1, 1, 5, 10% 중량비를 의미한다.
앞선 합성방법을 통해 얻어진 물질은 다양한 방법을 통하여 분석을 실시하였다. 물질의 결정 구조는 X선 회절분석기(XRD, Rigaku D/MAXRINT 2000)를 이용하여 40 kV, 100 mA 조건에서 2θ를 20~80°의 범위로 분석하였다(Cu Kαradiation (λ = 1.5418740˚A) as X-ray source). 물질의 형태는 투과전자현미경(TEM, JEM-2010)으로 16kV, 8.5 nm WD value 조건에서 분석하였다. 투과전자현미경을 사용한 측정 전 시료 준비는 에탄올에 시료를 충분히 분산시킨 후 holy grid에 떨어뜨린 후 충분히 말려 고정시켰다. 투과전자 현미경 내부의 에너지분산형 분광분석기(EDS, QUANTAX)를 통해 물질의 구성 원소를 파악하였다. 라만분광기(NRS-3100)를 이용하여 532 nm 레이저 광선으로 100~4000 cm-1 구간으로 분석을 실시하였다. 물질 내 결합을 알아보기 위해 X선 광전자분광기(XPS, VG Multilab 2000)를 X-ray 광선(Al Kα, 1253.6 eV)로 10 kV, 30 mA 조건으로 분석하였다. 재결합분석을 위해 광발광(PL, MonoRa750i/ ELT1000) 분석을 한다. He-Cd 레이저(325 nm)를 광원으로 사용하였다. 비표면적(BET, Autosorb-iQ 2ST/MP, Quanta-chrome)분석은 질소로 포화하여 진행하였다.
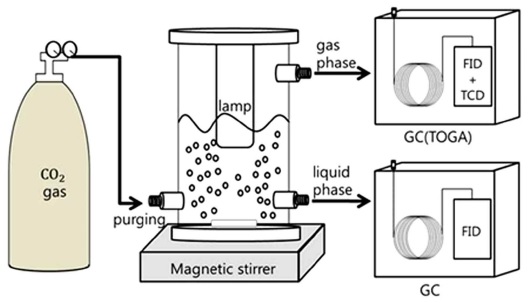
CO2 광환원 실험은 제작된 실린더형 반응기에서 진행되었다. 실린더형 반응기는 전체적으로 유리로 만들어졌으며 내부직경은 70 mm이며 높이는 285 mm이다. 합성된 광촉매는 0.3 g을 300 ml 탈이온수에 넣어 실험을 진행하였다. CO2가스(99.999%)를 30분간 불어넣어 내부를 포화시켰다. 포화시킨 후 UV 램프(UVC, 254 nm, 8 W, Sanko Denky)를 켬으로 실험을 시작하였다. UV램프의 빛을 실험에 최대한 효율적으로 사용하고 외부요인의 차단을 위해 유리반응기 주위에 알루미늄 호일로 둘러쌌다. 반응기에서 생성된 가스는 오일교환형 가스크로마토그래피(TOGA, gas chromatography, Porapak Q and molsieve 13X column)으로 측정하였다. 가스시료 채취는 반응기와 TOGA 간 튜브 연결하여 실행하였다.
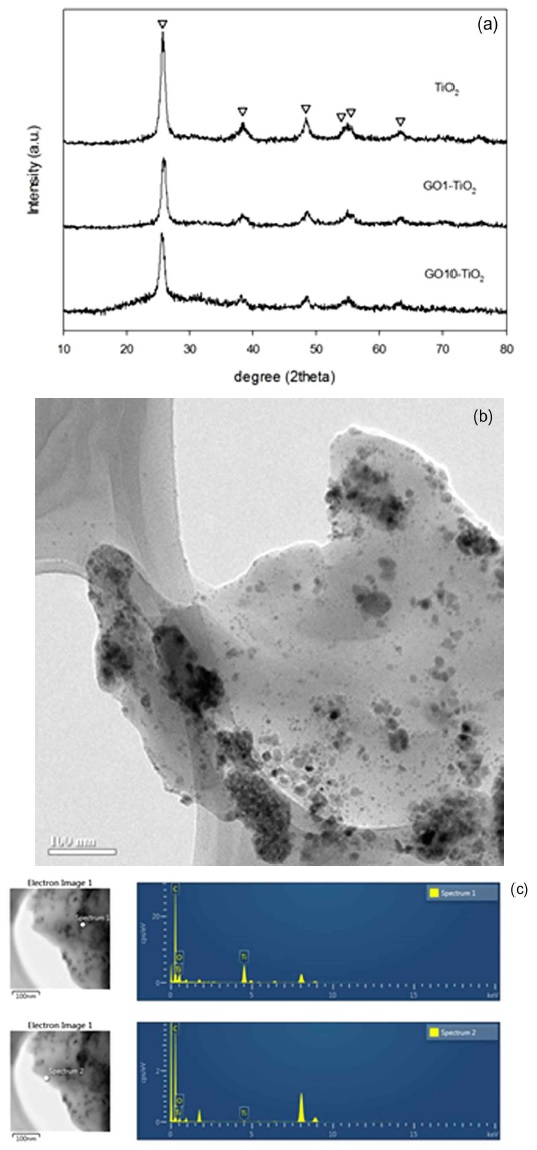
XRD 분석을 통하여 TiO2의 결정을 분석 및 합성과정의 영향을 알아볼 수 있다. 일반적인 TiO2는 Anatase 결정과 Rutile 결정구조를 띠고 있으며, 그 중 Anatase 결정이 Rutile 결정에 비하여 보다 높은 전자 전달능력으로 인하여 광활성이 높다고 알려져 있다(Liu, Zhao et al., 2012). TiO2의 Anatase 결정은 XRD 분석 상에서 Fig. 2(a)와 같이 주 피크인 25.3°와 더불어 37.8°, 48.0°, 53.8°, 55.0°, 62.1°에서 피크를 보였다. 상단의 순수한 TiO2 나노입자와 GO와 조합한 TiO2의 XRD 피크에서도 같은 위치에 피크를 보였다. 이는 GO와 조합한 TiO2 또한 모두 Antase 결정의 TiO2를 가지며 또한 GO와의 조합을 위한 합성과정에서 TiO2의 결정에 영향을 미치지 않음을 알 수 있었다. 또한 XRD 분석 결과를 Anatase 결정의 (101) 단면을 의미하는 주 피크인 25.3°의 반값 반폭과 Scherrer 공식을 이용하여 TiO2의 평균 결정 크기를 구하였다. 그 결과 순수 TiO2 입자크기는 10.68 nm이며 다른 물질의 입자크기 또한 유사하게 나왔다. 이 값은 졸겔법으로 합성한 TiO2 나노입자크기인 10~20 nm와 유사함을 알 수 있었다.
합성물의 형태는 Fig. 2(b)의 TEM 분석을 통해 확인하였다. TEM 분석 결과로 TiO2 입자임을 분명하게 확인하였으며 GO의 탄소시트 위에 부착되어 있음을 확인하였다. 그 중 많은 TiO2 나노입자가 탄소시트의 가장자리에 위치하고 있는데 이는 일반적인 GO의 탄소시트 가장자리에 위치한 카르복실기와 연결될 것으로 추측이 가능하다. Fig. 2(c)은 한 지점에서의 EDS 스펙트럼을 보여준다. 이를 통해 분석하고자 하는 지점의 구성원소를 파악하였는데 나노입자가 위치한 지점에서는 Ti 원소가 나타나지만 나노입자가 없는 부분에서는 Ti 원소가 보이지 않기에 나노입자가 GO 시트위에 부착해있음을 확실히 알 수 있었다.
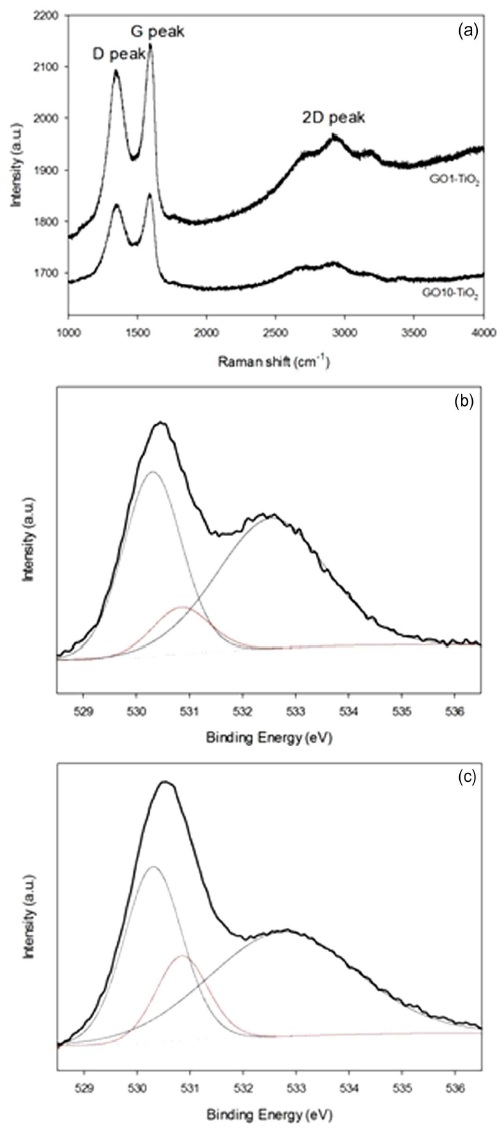
라만 분석은 그래핀 물질 분석의 일반적인 방법으로 GO같은 경우 Fig. 3(a)와 유사한 패턴을 보여주었다. 라만 스펙트럼 내 1340 cm-1와 1580 cm-1는 각각 D 피크, G피크로 불린다. G피크는 그래핀 시트의 탄소간 sp2 결합을 의미하며 D 피크는 그래핀 물질의 sp3 결함을 나타내는 것으로 그래핀 내 산소 작용기로 인해 sp2 결합을 이루지 못함을 의미한다(Kudin et al,. 2008). GO비율에 따른 D피크와 G피크의 비는 GO1-TiO2의 경우 1.15, GO10-TiO2의 경우 1.14로 비슷하게 유지함을 보여주었다. GO비가 늘어도 D피크와 G피크의 비가 일정하게 유지됨을 보여주기에 합성 과정에서 GO의 탄소시트 영향을 끼치지 않음을 알 수 있다. 2680 cm-1에서의 2D 피크는 탄소의 sp2 결합의 겹침을 의미해 그래핀 시트가 겹쳐져 있음을 의미한다. 낮은 2D 피크는 GO가 몇 개의 층으로 이뤄짐을 알 수 있었다.
Fig. 3(b)에서의 XPS 분석으로 GO와 TiO2 간 결합을 분석하였다. 산소 1s의 XPS 스펙트럼의 다양한 피크 중 530.9 eV에 위치한 피크는 탄소와 산소간의 이중결합을 의미하며 이는 탄소시트의 카르복실기를 의미한다(Kim et al,. 2012). GO의 비율이 늘수록 530.9 eV의 피크가 감소함을 나타내기에 TEM 분석에서 추측한 바와 같이 카르복실기가 GO와 TiO2간 연결고리임을 알 수 있었다.
광반응은 광촉매의 표면적에서 일어나기에 광반응 효과 증진을 위해 표면적 향상은 필수적이다. 합성된 물질의 표면적은 BET 분석을 통해 확인하였다. 순수한 TiO2 나노입자의 경우 나노입자의 특성인 열역학적 불안정으로 인한 응집 현상으로 다른 물질에 부착하는 형태 등으로 표면적을 늘려 광효율을 늘릴 수 있다(Perera et al., 2012). 순수한 TiO2 나노입자의 표면적(94.08 m2/g)에 비해 GO10-TiO2의 표면적(116.27 m2/g)이 더욱 넓은 것을 확인하였다.
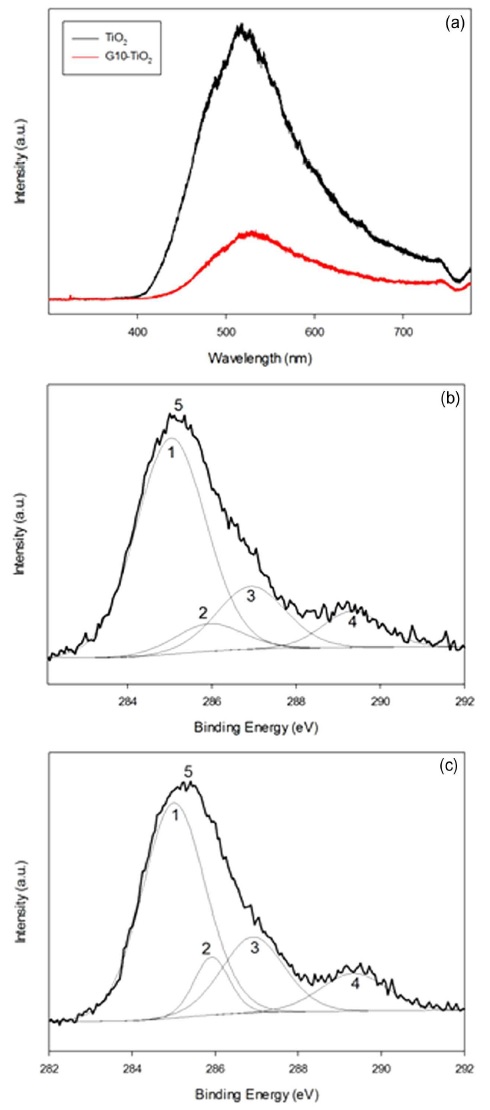
TiO2의 광효율 저하의 주요 요소인 홀-전자 재결합 반응으로 이는 PL 분석을 통해 비교분석하였다. Fig. 4(a)에서의 PL 스펙트럼에서 보여주듯이 순수한 TiO2에 비해 GO10-TiO2는 낮은 PL 값을 보여주기에 이를 통해 GO와 조합이 낮은 재결합 반응을 나타내는 것으로 알 수 있다.
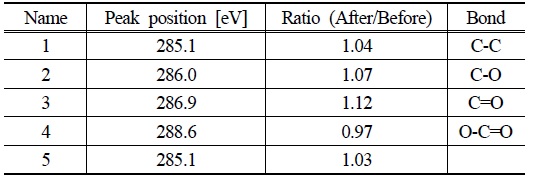
TiO2는 광반응에도 안정적이지만 GO는 광반응으로 인해 영향을 받을 수 있다(Williams et al., 2008). 이에 GO-TiO2 물질의 안정성 확인을 위해 광반응 전후의 GO-TiO2를 XPS 분석을 실시하였다. Table 1와 Fig. 4(b), (c)에서 보여주듯이 광반응 전후의 XPS 스펙트럼에 큰 차이가 없는 것으로 확인되었다. 이를 통해 광반응에도 GO가 큰 영향을 받지 않으며 반응이 가능함을 확인하였다.
[Table 1.] C 1s core level XPS spectra of peak ratio before and after experiment
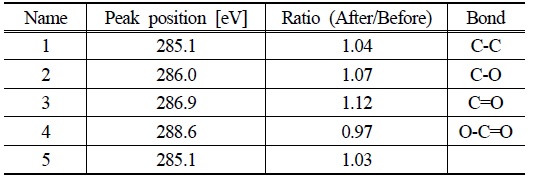
C 1s core level XPS spectra of peak ratio before and after experiment
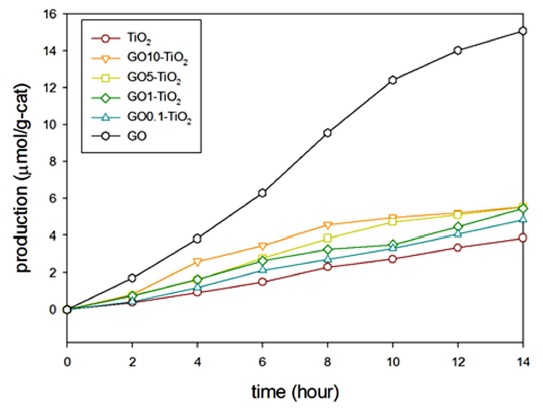
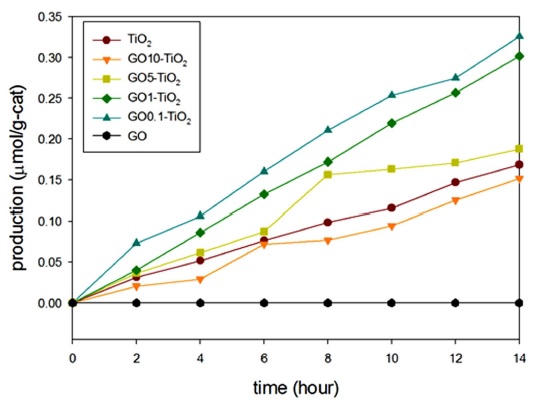
본 CO2 광환원 실험에서 주요 생성물은 일산화탄소와 메탄이다. 메탄의 환원 전위(-0.24V)가 일산화탄소의 환원 전위(-0.54V)보다 낮기에 에너지적인 측면에서는 메탄이 더욱 우호적이다. 그러나 실제 실험결과로는 일산화탄소가 주요 생성물이었다. 이는 에너지 준위 측면보다는 전자전달 측면이 이번 실험에 주요 제한 인자임을 확인하였다.
메탄 생성을 위한 필요전자갯수(8개)에 비하여 일산화탄소는 보다 적은 필요전자갯수(2개)를 필요로 하기에 일산화탄소가 보다 많이 생성되었다.
GO와 TiO2조합의 합성을 이용한 CO2광환원의 효율 증가를 시간에 따른 일산화탄소와 메탄 생성 그래프를 통해서 확인하였다. 일산화탄소 생성이 가장 높은 경우는 GO10-TiO2에서 0.652 μmol/g·h이었으며 이는 순수 TiO2에 비해 약 2.3 배 높은 효율을 나타냄을 확인하였으며 GO 비율이 증가함에 따라 일산화탄소 생성 또한 증가함을 확인하였다(Fig. 5). 메탄 생성에서는 GO0.1-TiO2에서 0.037 μmol/g·h로 가장 높은 효율을 보였으며 이는 순수한 TiO2에 비해 약 2.4 배 높은 효율을 나타냄을 확인하였다(Fig. 6). 이를 통해 순수 TiO2보다 커진 비표면적과 홀-전자 재결합 현상의 감소로 인하여 CO2 광환원 효율이 증가하였으며 GO와 TiO2간 좋은 결합임을 확인하였다.
기존 TiO2를 개질한 CO2 광환원의 연구는 대표적인 금속 도핑 효과처럼 TiO2와 합성물질의 최적비율까지 합성물질이 증가함에 따라 일산화탄소와 메탄의 생산량이 똑같이 증가하는 경향을 보이며 이는 환원된 GO를 사용하여 TiO2를 개질한 연구에서도 유사한 결과를 보인다(Kočí et al., 2010). 이에 반하여 이번 연구에서는 Fig. 5, 6에서 확인할 수 있듯이 메탄 생성에서는 GO 함량이 증가함에 따라 메탄 생성이 감소함을 확인하였으며 이는 일산화탄소 생성과 다른 경향을 보임을 확인하였다. 기존 TiO2의 개질방법인 금속 도핑이나 환원된 GO과 조합의 경우는 개질물질의 높은 전자전달율을 통한 전자전달 개선 효과로 인해 광환원의 효율이 증가하게 된다(Tan et al., 2013). 이에 반하여 이번 연구에 사용된 GO는 그래핀에 비해 전도율이 낮아 전자전달 측면에서 불리하며 이는 메탄생성에 부정적인 영향을 끼친 것으로 추측된다.
졸겔법을 통한 TiO2 나노분말과 GO의 장시간 교반을 통하여 기존의 환원된 GO 형태가 아닌 일반 GO와 TiO2 조합을 합성하였다. 합성된 형태의 GO-TiO2은 그래핀 탄소판 위로 TiO2 나노분말이 쌓여있는 형태이며 결합을 통하여 안정성을 확인하였으며, 순수 TiO2 대비 GO와의 조합을 통한 광환원 생성효율의 향상을 확인하였다. 합성된 GO-TiO2 조합을 이용한 CO2 광환원 실험의 결과는 일산화탄소 생성은 GO10-TiO2에서 0.652 μmol/g·h을 보였으며 (순수 TiO2의 2.3배), 메탄 생성은 GO0.1-TiO2에서 0.037 μmol/g·h을 보임을 확인하였다(순수 TiO2의 2.4배). 또한 기존의 환원된 GO를 적용한 연구에서는 메탈 도핑의 효과처럼 주요생성물인 일산화탄소와 메탄이 환원된 GO의 최적 비율까지 같이 증가하는 경향을 보였다면 이번 연구에서는 GO의 비율에 따른 메탄과 일산화탄소 생성의 경향이 다름을 확인하였다(Kočí et al., 2010). 이는 GO의 표면적 증대 및 홀-전자 재결함 현상 감소를 통해 CO2 광환원의 전반적인 효율은 증가하였지만 반도체 성질을 가져 전기전도율이 낮은 GO로 인해 많은 전자 전달을 필요로 하는 메탄 생성의 경우 GO량의 증가가 오히려 불리함을 확인하였다. 본 연구에서 제시된 GO-TiO2를 이용한 CO2 환원은 CO2 농도가 높은 상황에 직접 적용할 수 있을 뿐만 아니라, CO2가 포함된 수환경에서의 적용성도 향후 연구를 통하여 조사해 볼 가치가 있다.